Définition de la géométrie moléculaire
Divers / / January 11, 2022
Définition conceptuelle
C'est la structure d'une molécule qui détermine la disposition tridimensionnelle des atomes qui la composent dans l'espace.

Ingénierie chimique
Les géométries moléculaires sont actuellement définies sur la base de la Théorie de Répulsion des Paires Électroniques de la Couche de Valence (TRPECV). Cette théorie permet de prédire le comportement chimique de substances (notamment covalentes) et aide à comprendre les Distribution électronique, conduisant à géométrie de la molécule. Ceci, à son tour, nous permet de comprendre de nombreuses propriétés que les substances acquièrent.
Cette Théorie est basée sur une série de piliers fondamentaux que nous allons passer en revue puis essayer de comprendre leur application entraine toi. En premier lieu, les électrons liés et non liés (valence) sont considérés comme une mer d'électrons qui, par possèdent le même type de charge, ils se repoussent, donc ils seront toujours situés aussi loin de l'atome central du molécule.
Deuxièmement, cette "mer" d'électrons ou "nuage électronique" forme des zones de haute densité électronique, qui sont constitués en liaisons, où les électrons sont partagés ou en paires d'électrons non partagés. À leur tour, les liaisons qui se forment peuvent être simples, doubles ou même triples.
Enfin, pour décider géométrie moléculaire, il est très utile d'avoir la structure de Lewis, où la quantité de densités d'électrons autour de l'atome central sera comptée et cela donnera indication du nom de sa géométrie et de la forme que prend la molécule en trois dimensions.
Il est à noter que ces densités seront situées le plus loin possible les unes des autres, afin d'adopter la structure la plus stable et la moins répulsive. C'est ainsi que l'on identifie d'abord la géométrie électronique puis la géométrie moléculaire.
Six niveaux de densité
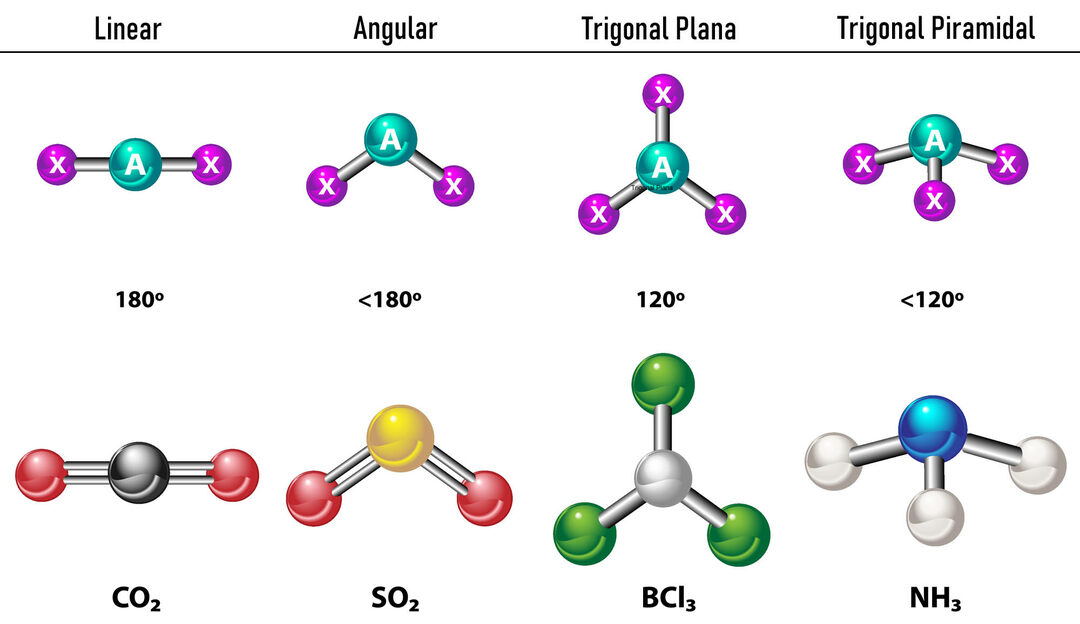
Dans le cas où il y a deux densités d'électrons autour de l'atome central, les liaisons seront situées aussi loin l'une de l'autre entre eux, c'est-à-dire à 180º l'un de l'autre et, par conséquent, leur géométrie électronique est linéaire et moléculairement elle est également linéaire.
Dans le cas où il y a trois densités d'électrons autour de l'atome central, il y a deux options: trois liaisons ou deux liaisons et une paire non liée. S'il y a trois liaisons, la géométrie électronique est Plat trigonal, avec des angles de 120º entre les liaisons et la géométrie moléculaire porte le même nom. Maintenant, s'il y a une paire non liée, ils se repoussent avec plus intensité que les charges liées ont donc tendance à comprimer les angles de liaison. L'angle entre la paire libre et chaque liaison est de 120º et la géométrie électronique est le plan trigonal tandis que la géométrie moléculaire est angulaire.
Dans le cas où il y a quatre densités d'électrons autour de l'atome central, la géométrie électronique est tétraédrique. Si les quatre paires d'électrons sont liées, leur géométrie moléculaire coïncide de nom avec leur géométrie électronique et l'angle de liaison est de 109,5º. Maintenant, si l'une des paires est libre, l'angle de liaison devient plus petit (107º) et la géométrie moléculaire est de type Pyramide Trigonale. Enfin, si deux sont des paires libres et deux sont liées, l'angle de liaison est de 104,5° alors que la géométrie moléculaire est appelée Angulaire.
Lorsque les densités d'électrons autour de l'atome central s'élèvent à cinq, on parle de Bipyramide trigonale sa géométrie électronique. Si toutes les charges sont liées, il y a des angles de 120ºC entre les liaisons situées à l'équateur et de 90º entre les liaisons axiales avec les liaisons équatoriales. Maintenant, la géométrie moléculaire est également appelée trigonale bipyramide tandis que, ayant quatre paires liées et une paire libre, la géométrie moléculaire est déformée formant le bien connu "bascule», Là, le nom qu'il acquiert est Tétraèdre déformé. Alors que, si deux des cinq paires d'électrons sont libres et que trois d'entre eux sont liés, il a une géométrie en forme de « T » et son nom est précisément dû à sa structure. Enfin, si c'est l'inverse, trois paires libres et deux charges liées, la géométrie moléculaire est linéaire.
Enfin, il y a six densités d'électrons autour de l'atome central et un octaèdre se forme, d'où son nom en géométrie électronique. De même, la géométrie moléculaire est nommée si toutes ses paires sont liées. Si vous avez cinq paires liées et une paire libre, la géométrie moléculaire est Pyramide à base carrée. Si vous avez quatre paires liées et deux paires libres, la géométrie moléculaire est Carré Plat.
Figure: Nature douce
Sujets en géométrie moléculaire