Concept dans la définition ABC
Divers / / April 22, 2022
définition du concept
Les azéotropes sont des mélanges de composés chimiques, de composition définie, qui bout à certaines températures. La caractéristique fondamentale est que le mélange se comporte comme s'il s'agissait d'une seule substance pure, conservant ses propriétés et offrant une facilité de manipulation.

Ingénierie chimique
Le mélange peut être donné par deux composants ou plus et son composition il est le même aussi bien en phase liquide qu'en phase gazeuse, cela génère des similitudes avec les corps purs. On en déduit facilement que ce mélange ne peut pas être séparé en ses composants par des procédés tels que distillations fractionnées car, comme mentionné ci-dessus, il conservera ses proportions, se comportant comme s'il s'agissait d'un seul composant.
Une autre caractéristique est que le point d'ébullition de ce mélange peut être supérieur, inférieur voire égal à celui de l'un de ses composants. Lorsque l'azéotrope bout à une Température d'ébullition maximale, il est appelé azéotrope maximal et lorsqu'il le fait à la température la plus basse possible, il est appelé azéotrope minimal. Cela signifie que l'azéotrope minimum a un point d'ébullition inférieur à ses composants purs et vice versa avec l'azéotrope maximum. Par exemple, dans le mélange méthanol - benzène, l'azéotrope est minimum (0,61 benzène - 0,39 méthanol dans les fractions molaire) dont le point d'ébullition est de 58 °C, dans une cuve où le point d'ébullition du benzène est de 80 °C et celui du méthanol 65°C
Azéotropes minimum et maximum
Maintenant… d'où vient un azéotrope? Lorsqu'il y a un écart par rapport à la Droit Raoult, c'est-à-dire que la pression de vapeur du mélange azéotropique n'est pas directement liée à sa fraction molaire, c'est quand le concept de mélange azéotropique apparaît. Ces déviations se produisent lorsque les composants s'attirent ou se repoussent de manière significative, c'est-à-dire que les forces intermoléculaires sont très différentes dans différents composés.
Lorsque l'écart est positif, on a l'azéotrope minimum, alors que si l'écart est négatif, on a l'azéotrope maximum. Pour mieux comprendre ce concept, regardons quelques graphiques :
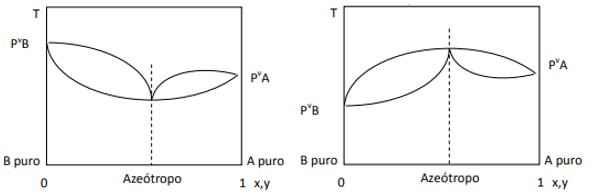
Ici, nous observons que, si le mélange était idéal, selon la loi de Raoult, les pressions de vapeur des composants purs devraient être reliées par une ligne droite, puisque eh bien, il y a un écart à cette loi qui provoque la formation d'azéotropes minimum et maximum, selon qu'il y a plus ou moins d'affinité entre les Composants. Lorsque l'écart à la loi de Raoult est négatif, comme sur la figure de gauche, il est minimal à diagramme de pression, mais un maximum dans le diagramme de température (donc, azéotrope du maximum). En revanche, si l'écart est positif à la loi de Raoult, il sera maximum dans la pression vs. composition, mais un minimum dans le diagramme de température vs. composition (ici on a un azéotrope minimum). Ne confondez pas les diagrammes pression vs. composition et température vs. composition.
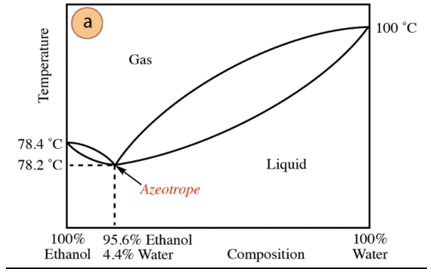
Dans le cas du mélange éthanol-eau, il existe un azéotrope minimum dont la composition est de 95,6 % d'éthanol et de 4,4 % d'eau. La température d'ébullition du mélange azéotropique est inférieure de 78,2 °C à celle des composants purs. Supposons donc que l'on distille un mélange eau-éthanol à forte teneur en eau (proche de 100%). Il ne sera pas possible d'obtenir de l'alcool pur, car des fractions plus importantes seront obtenues à chaque étape de distillation. d'éthanol, mais n'atteignant jamais 100 %, il se rapprochera progressivement de la composition du mélange azéotropique (le point le plus bas bas). C'est pourquoi, comme l'eau, il a tendance à former un minimum d'azéotropes avec composés organiques (compte tenu du type de forces intermoléculaires qui interagissent), il est nécessaire d'éliminer préalablement l'eau du mélange pour obtenir le composé pur. Ou, une fois l'azéotrope obtenu, des méthodes de extraction d'eau supplémentaire.
D'après ce qui précède, ce n'est pas par hasard que l'on trouve de l'alcool (au supermarché et pharmacie) à 95%, est le produit le moins cher que l'on puisse obtenir. Pour obtenir de l'alcool pur, il faut "casser" l'azéotrope avec technique supplémentaires, comme l'utilisation d'agents desséchants ou de distillations azéotropiques. La distillation azéotropique consiste à ajouter un composant supplémentaire au mélange qui agit par entraînement et par interaction avec n'importe lequel des composants du mélange (affinité plus élevée) peut être éliminé du mélange.
Sujets en azéotropes


