Définition de l'équilibre chimique
Inhibition La Théorie Des Cordes / / April 02, 2023
1. Condition de stabilité présente dans les réactions réversibles où les vitesses de réaction directe et inverse restent toujours les mêmes.
Chat. grammatical: nom masculin
en syllabes: e-qui-li-brio + qui-mi-co.
Bilan chimique

Ingénierie chimique
Une réaction est en équilibre chimique lorsque le vitesse de réaction direct est égal à vitesse réaction inverse. Tous réaction chimique a une certaine spontanéité vers l'équilibre, et pour l'étudier nous le faisons à travers le signe de ∆G, Énergie Gibbs libre, ce qui implique que, grâce à la valeur de cette grandeur, on peut prédire si une réaction se produira dans une certaine direction ou non.
La variation de l'énergie libre de Gibbs s'exprime, en général, dans des conditions standard comme la différence entre les énergies des produits et des réactifs également à l'état standard :
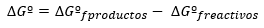
Alors que, si la réaction se produit dans des conditions non standard, la relation entre ∆Gº et ∆G est déterminée par ce qui suit expression:
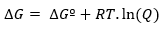
où Q est le quotient de réaction.
Pour comprendre les implications de la vitesse de réaction et de l'équilibre chimique, nous devons étudier le signe de ∆G :
Si ∆G est négatif, cela implique que la réaction est spontanée (se produit) au sens direct.
Si ∆G est positif, cela implique que la réaction n'est pas spontanée (ne se produit pas) au sens direct.
Tandis que, si ∆G=0, il n'y aura pas de changement, puisque le système est en équilibre, et comme déjà mentionné, la vitesse de réaction directe est égale à la vitesse de réaction indirecte. Cela implique que le quotient de réaction Q est égal à la constante d'équilibre K, il n'y a donc pas de tendance à favoriser une direction spécifique de la réaction.
Puisque Q est défini comme :
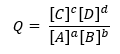
Pour une réaction générique :
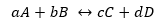
Tandis que K prend la même forme, mais avec les concentrations en équilibre.
Si on revient au cas où ∆G est négatif, cela implique que le quotient de réaction Q est inférieur à K (constante de équilibre), implique que les concentrations de produit sont inférieures à ce qu'elles devraient être si la réaction était en cours. équilibre. Donc, en termes de spontanéité, il devient spontané au sens direct.
Alors que si ∆G est positif, il y aura une prépondérance de produits au-dessus de ce qu'il devrait y avoir si le système était en équilibre, Q étant supérieur à K. La réaction est donc spontanée en sens inverse.
Il convient de noter que la définition stricte de Q et K est donnée en termes d'activités des produits et des réactifs, définissant l'activité en termes de concentration ou de pressions comme :
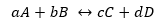
Ou bien:
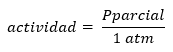
De là, il ressort que Q et K sont sans dimension et peuvent être considérés à la fois en concentrations et en pressions partielles.
Lorsque les concentrations ou les pressions partielles des produits et des réactifs restent constantes dans le temps, la situation se produit équilibre chimique, tandis qu'une situation d'équilibre dynamique est atteinte car la vitesse de réaction directe et inverse avec identique. Il est important de souligner le dynamisme des équilibres, la rapidité avec laquelle ils se forment et consommer produits et réactifs est la même, c'est pourquoi les concentrations ou pressions partielles ne cela varie.
Si la condition s'éloigne de la situation d'équilibre, certaines espèces prédomineront sur d'autres et de là naît l'expression qui relie le taux de réaction directe et inverse, Kc :
Supposons la réaction vue ci-dessus :
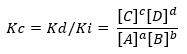
Étant Kd et Ki, les constantes de vitesse de réaction respectivement dans le sens direct ou inverse.
Encore une fois, si Kc> 1, cela implique que Ki est inférieur à Kd, il y a donc un degré élevé de conversion des produits en réactifs. Dans ce cas, l'équilibre est déplacé vers les produits.
L'inverse se produit si Kc<1, ce qui implique que la vitesse de réaction directe est inférieure à la vitesse de réaction indirecte et qu'il y a peu consommation des réactifs, l'équilibre se déplace vers les réactifs.
Alors que si Kc=1, les vitesses sont égales et le système est en équilibre.
Il est important de définir deux problèmes: premièrement, la valeur de cette constante dépend exclusivement de la température et, à son tour, varie selon la grandeur utilisée pour exprimer les concentrations ou les pressions des produits et des réactifs.
Enfin, le loi L'équilibre chimique s'ajuste aux solutions diluées ou aux gaz sous basse pression.
