50 exemples d'aldéhydes et de cétones
Exemples / / November 06, 2023
Les aldéhydes ils sont composés organiques qui ont dans leur structure un groupe fonctionnel carbonyle (= C = O) lié à une chaîne carbonée et à un atome d'hydrogène. Par exemple: le méthanal (également appelé formaldéhyde), l'éthanal (également appelé acétaldéhyde) et le propanal (également appelé propaldéhyde).
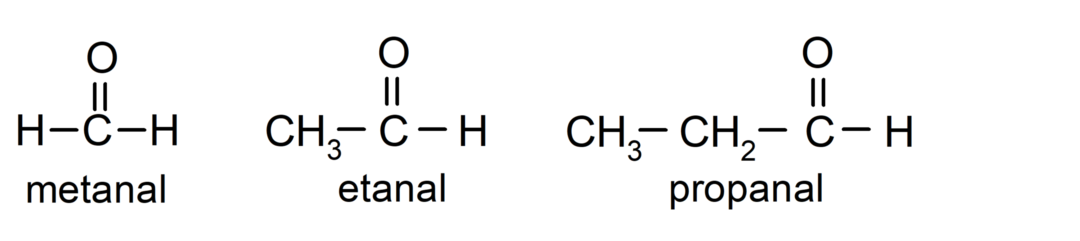
Le cétones Ce sont des composés organiques qui ont dans leur structure un groupe carbonyle lié à deux atomes de carbone. Par exemple: la propanone (également appelée acétone), la butanone et la 2-pentanone.
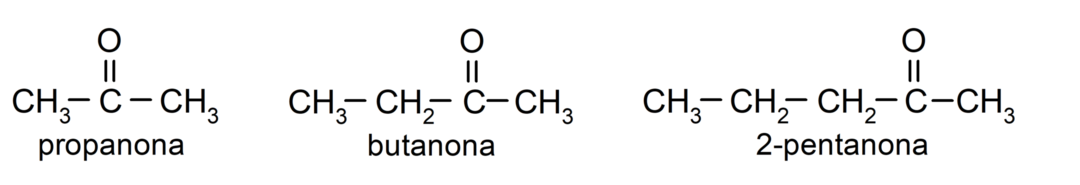
Différences entre les aldéhydes et les cétones
Les principales différences entre les aldéhydes et les cétones sont :
- Les aldéhydes ont dans leur structure une fonction carbonyle située à une extrémité terminale, tandis que les cétones ont le groupe carbonyle situé dans des positions non terminales de leur structure.
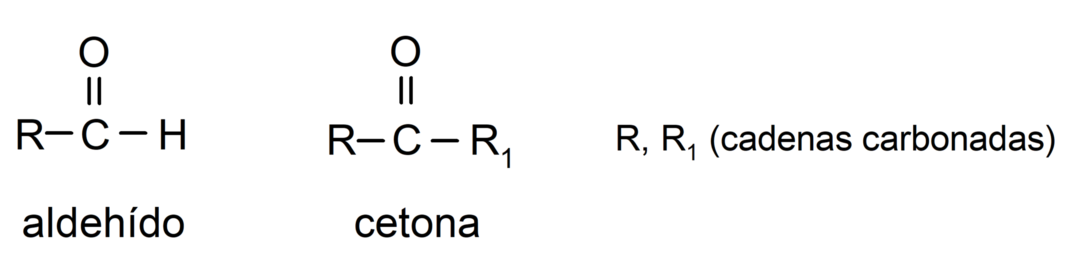
- Les aldéhydes sont oxydés par réaction avec le réactif de Tollens, formant de l'argent métallique. Ils s'oxydent également contre le réactif de Benedict, formant de l'oxyde cuivreux. Les cétones ne sont oxydées par aucun des deux réactifs.
- Les aldéhydes sont réduits en alcools primaires, tandis que les cétones sont réduites en alcools secondaires.
Propriétés physiques
Propriétés physiques des aldéhydes
Les propriétés physiques des aldéhydes sont très diverses car elles dépendent de la constitution de la chaîne carbonée liée au groupe carbonyle.
Quelques unes sont:
- Les aldéhydes les plus solubles dans l’eau sont ceux de plus petite taille, comme le méthanal et l’éthanal.
- Les aldéhydes volatils ont des odeurs piquantes et même irritantes.
- Le groupe carbonyle leur donne la polarité.
- Ils ont généralement des points d’ébullition plus élevés que les composés chimiques de taille moléculaire similaire.
Propriétés physiques des cétones
Les propriétés physiques des cétones dépendent de la manière dont se forme la chaîne carbonée liée au groupe carbonyle.
- De nombreuses cétones ont des odeurs agréables.
- Sa solubilité dans l'eau dépend de la taille de la chaîne carbonée attachée au groupe carbonyle. Plus la chaîne carbonée est petite, plus la cétone sera soluble dans l’eau.
- Le groupe carbonyle leur confère une polarité marquée.
- Ils ont des points d’ébullition assez élevés par rapport aux composés chimiques de taille moléculaire comparable.
Propriétés chimiques
Propriétés chimiques des aldéhydes
Parmi les propriétés chimiques des aldéhydes, on trouve :
Ils sont oxydés pour former l'acide carboxylique correspondant, c'est-à-dire que l'acide formé aura le même nombre de carbones dans la chaîne carbonée que l'acide formé. aldéhyde qui l'a donné naissance. Par exemple:
- Oxydation avec le réactif de Tollens (complexe ammoniacal argent en solution basique, [Ag (NH3)2]+) à partir de l'éthanal produit de l'acide éthanoïque et de l'argent métallique.
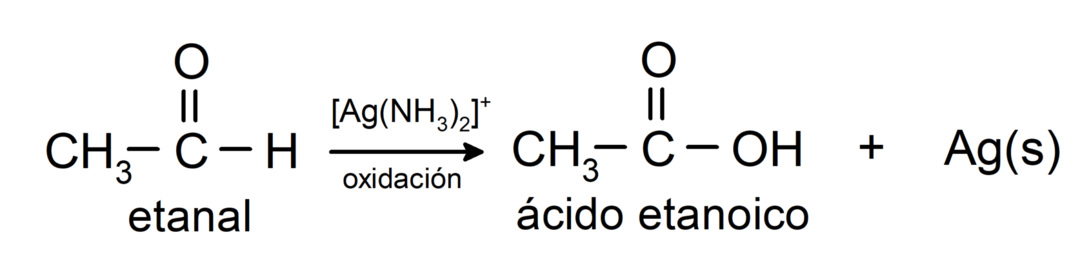
- L'oxydation avec le réactif de Benedict (solution alcaline de sulfate de cuivre) de l'éthanal produit de l'acide éthanoïque et de l'oxyde cuivreux.
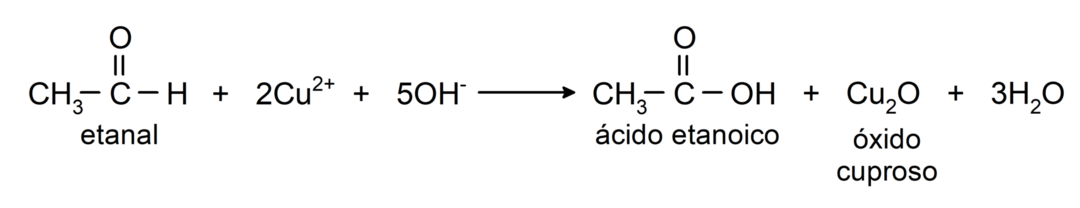
Ils subissent des réactions d'addition nucléophiles, c'est-à-dire l'ajout d'un nucléophile au groupe carbonyle. Par exemple:
- Ajout d'acide cyanhydrique pour former des cyanhydrines ou des cyanhydrines.
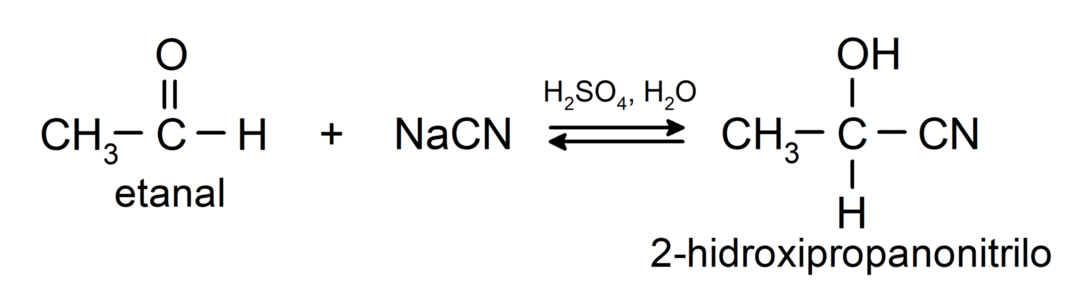
- En présence d'acides anhydres, des alcools sont ajoutés au groupe carbonyle des aldéhydes pour former des acétals et des hémiacétals.
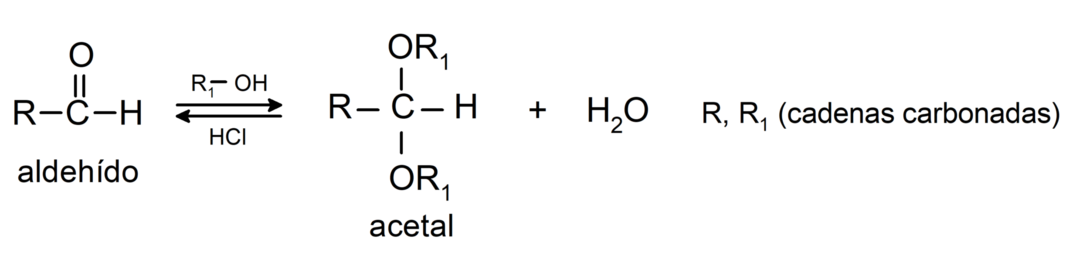
Ils subissent des réactions de condensation aldolique. Dans ces réactions, l'union de deux aldéhydes se produit en présence d'hydroxyde de sodium (NaOH) et du composé chimique le résultat est appelé aldol. Par exemple:
- Réaction de condensation de l'éthanal en présence de NaOH dilué.
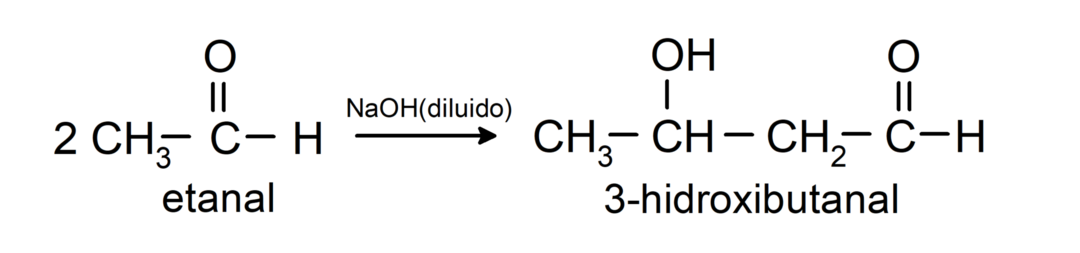
Ils sont réduits aux alcools primaires. Les aldéhydes peuvent être réduits en alcools primaires par hydrogénation catalytique ou par réduction avec du borohydrure de sodium (NaBH).4) et l'hydrure de lithium et d'aluminium (LiAlH4).
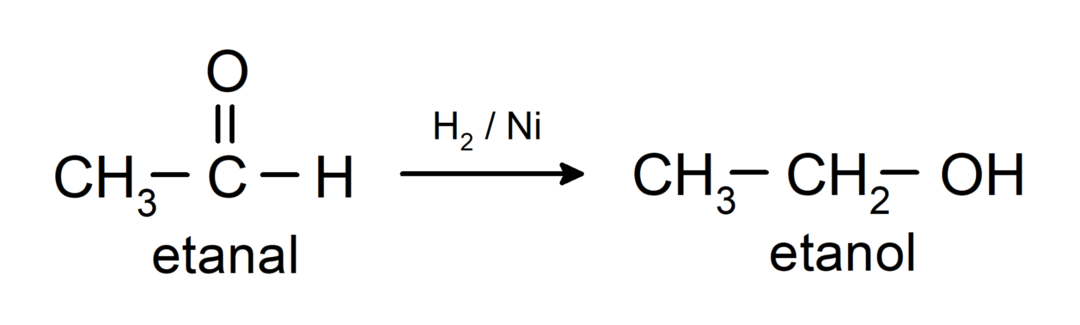
Propriétés chimiques des cétones
Parmi les propriétés chimiques des cétones, on retrouve :
Ils subissent des réactions d'addition nucléophiles. Par exemple:
- Ajout d'acide cyanhydrique pour former des cyanhydrines ou des cyanhydrines.
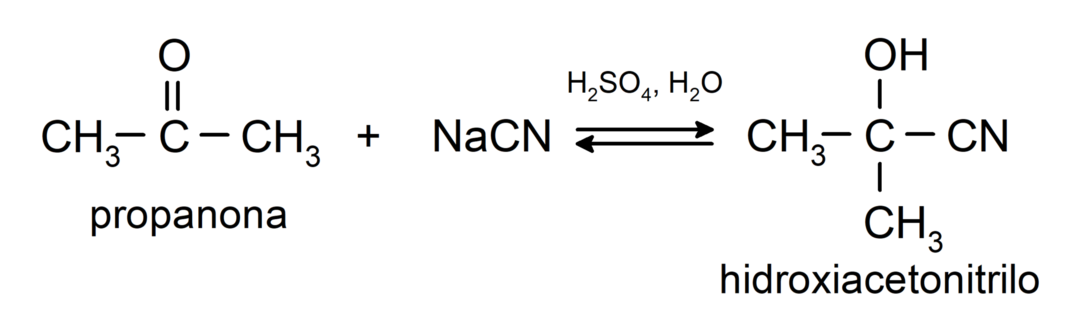
Ils ajoutent des alcools (en présence d'acides anhydres) au groupe carbonyle des cétones pour former des cétals et des hémicétals. Par exemple:
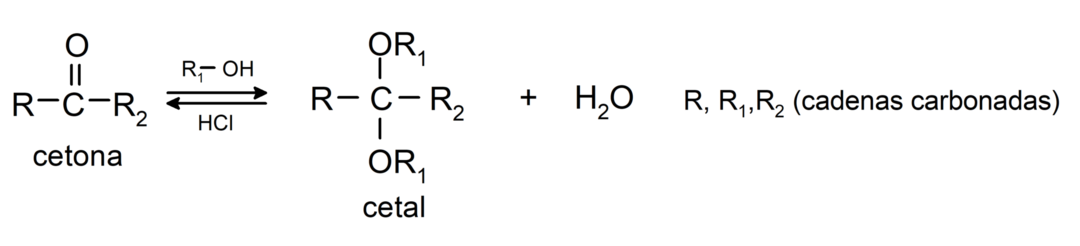
Ils subissent des réactions d'halogénation. Cétones qui ont un hydrogène alpha (α) réagissent en remplaçant cet hydrogène par des halogènes (chlore (Cl), brome (Br), iode (I), fluor (F)) en présence de catalyseurs acides ou basiques. La substitution se produit presque exclusivement dans le carbone α, c'est-à-dire le carbone qui s'est lié à l'hydrogène α. Par exemple:
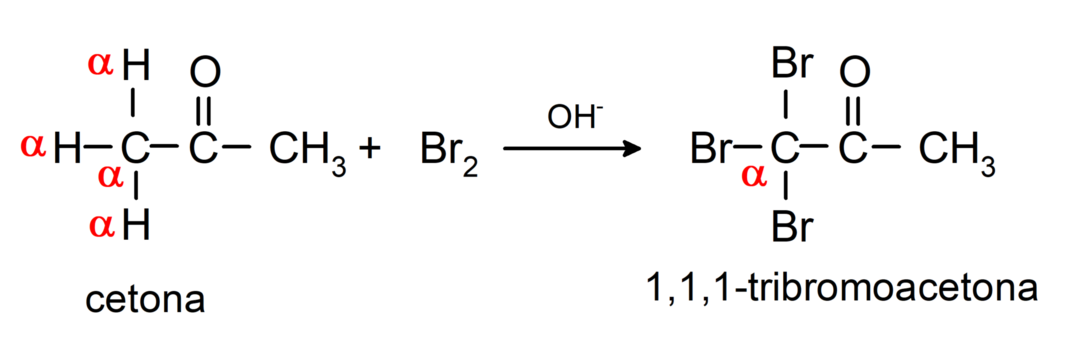
Ils sont réduits en alcools secondaires par hydrogénation catalytique ou par réduction avec du borohydrure de sodium (NaBH4) et l'hydrure de lithium et d'aluminium (LiAlH4). Par exemple:
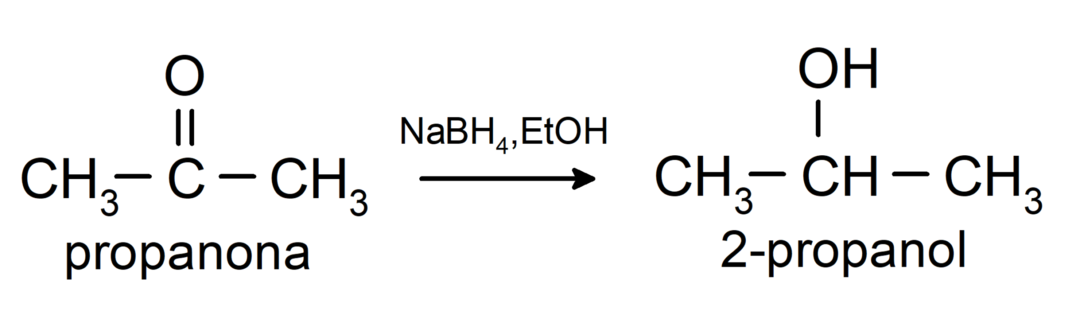
Les cétones ne sont pas oxydées par les réactifs Tollens et Benedict.
Nomenclature des aldéhydes
Selon les règles établies par l'Union Internationale de Chimie Pure et Appliquée (IUPAC), Les aldéhydes sont nommés à l'aide de préfixes qui indiquent le nombre de carbones dans la chaîne. gazéifié. Il n'est pas nécessaire de préciser la position du groupe carbonyle, puisqu'il est toujours en position un, à une extrémité de la molécule. De plus, le suffixe -al est écrit à la fin du nom de l'aldéhyde. Par exemple:
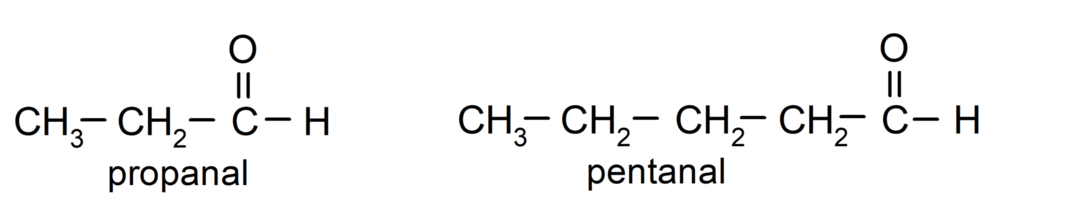
Si l'aldéhyde est constitué de plusieurs chaînes carbonées, c'est-à-dire qu'il comporte des branches, la chaîne carbonée comportant le plus grand nombre d'atomes de carbone est choisie comme chaîne principale. Les autres chaînes sont nommées groupes substituants et la position de chaque substituant est choisie de manière à ce qu'il occupe le plus petit nombre possible dans la chaîne. De plus, les atomes de carbone commencent à être comptés à partir de l’extrémité comportant le groupe carbonyle. Par exemple:
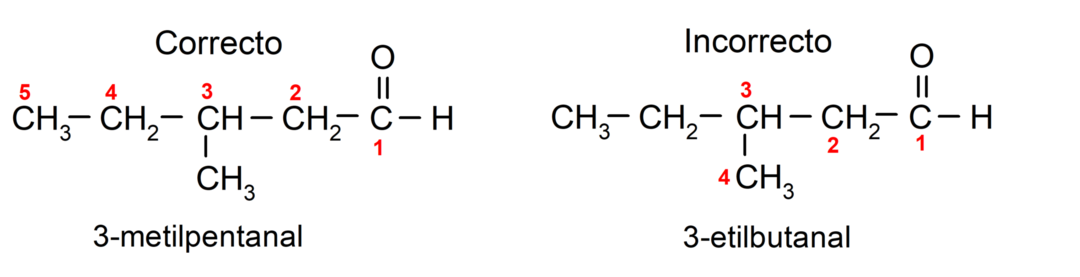
Les aldéhydes qui ont deux groupes carbonyle sont nommés en utilisant le suffixe -dial. Par exemple:
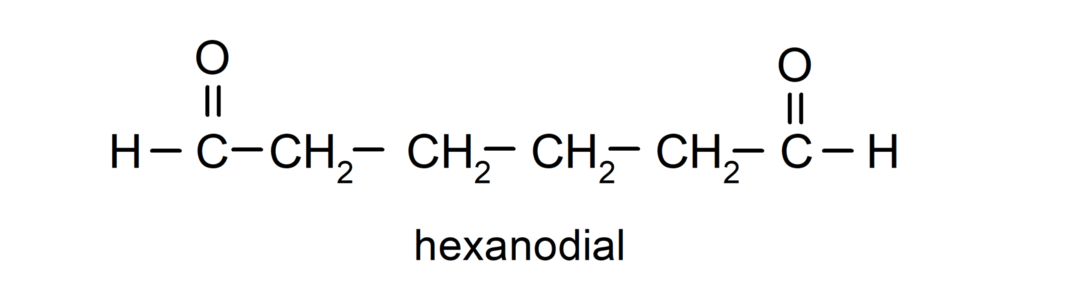
Nomenclature des cétones
Selon l'Union internationale de chimie pure et appliquée (IUPAC), les cétones sont nommées à l'aide de préfixes qui indiquent le nombre de carbones dans la chaîne carbonée.
En revanche, le nom de l'acétone s'écrit avec le suffixe -one, précédé d'un chiffre qui indique la position du groupe carbonyle dans la chaîne carbonée. L'emplacement du groupe carbonyle doit être choisi de manière à ce qu'il corresponde à la numérotation la plus petite possible. Par exemple:
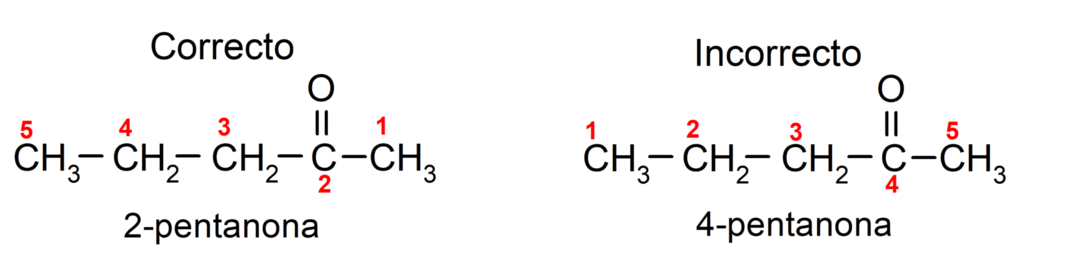
Pour nommer une cétone composée de plusieurs chaînes carbonées, c'est-à-dire avec des branches, on choisit comme chaîne principale, la chaîne carbonée comportant le plus grand nombre d'atomes de carbone et qui contient le groupe carbonyle. Le reste des chaînes est appelé groupe substituant. Par exemple:
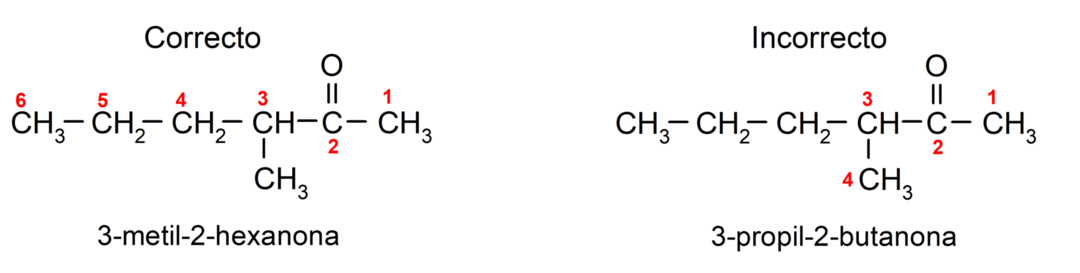
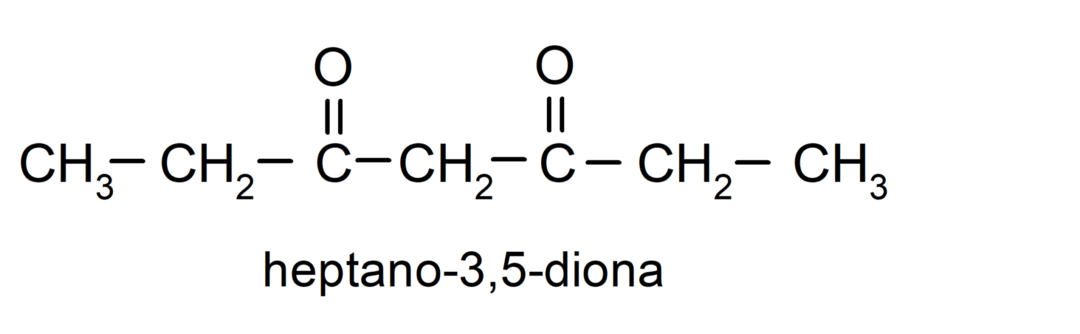
Il existe des cétones qui possèdent deux groupes carbonyle, on les appelle diones. Par exemple:
Exemples d'aldéhydes
- méthanal (formaldéhyde)
- éthanal (acétaldéhyde)
- propanal (propaldéhyde)
- butanal
- pentanal
- hexanal
- 3-bromocyclopentanecarbaldéhyde
- cyclohexanecarbaldéhyde
- benzaldéhyde
- 4,4-diméthylpentanal
- 2-hydroxy-butanal
- 2-hydroxy-2-méthyl-butanal
- 2,3-diméthylpentanal
- pentanedial
- 4-hydroxy-3-méthoxybenzaldéhyde
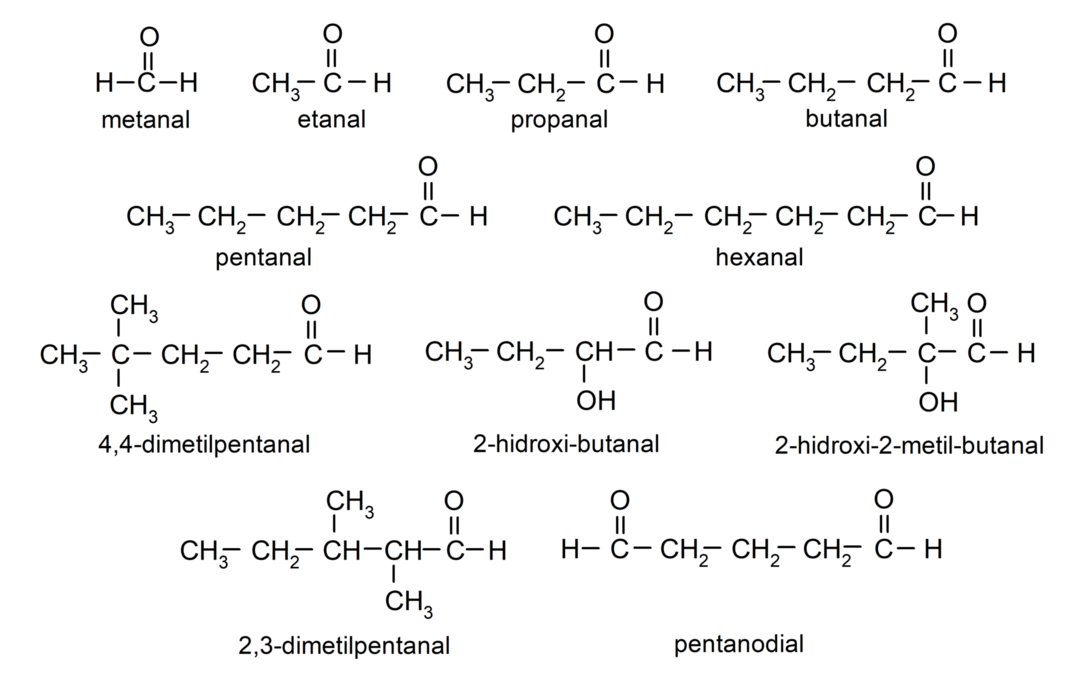
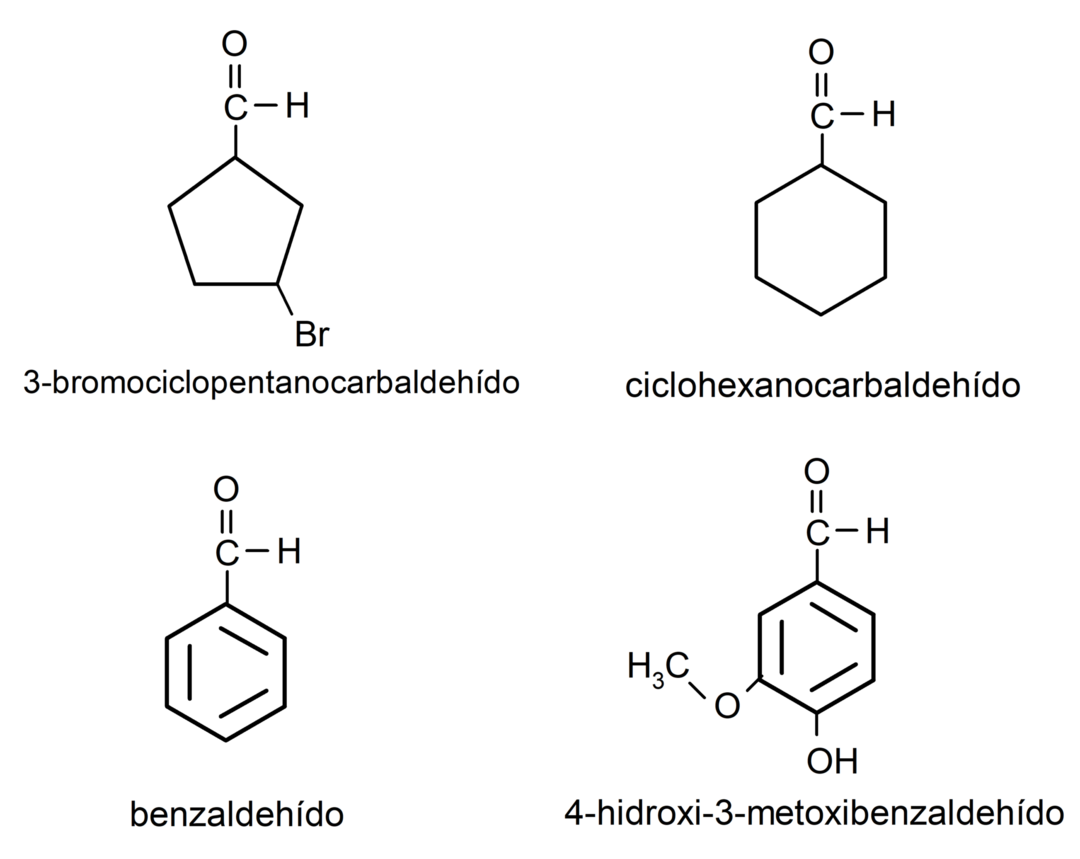
Exemples de cétones
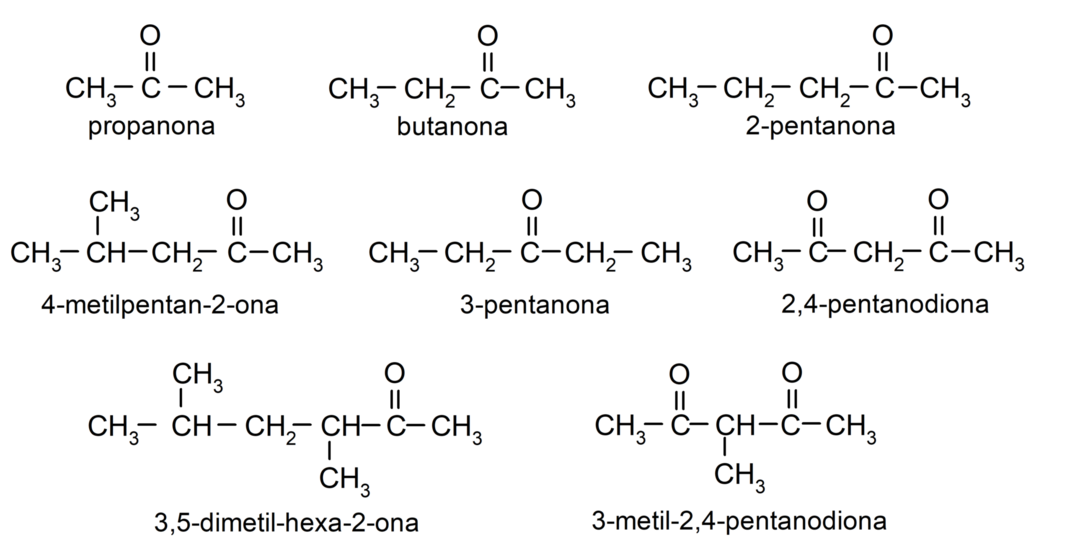
- propanone (acétone)
- butanone
- 2-pentanone
- 4-méthylpentan-2-one
- 3-méthylcyclohexanone
- cyclohexylméthylcétone
- 3,4 diméthyl-hexan-2-one
- éthylphénylcétone
- 2,4-pentanedione
- cyclohexanone
- 3-pentanone
- 3-méthyl-2,4-pentanedione
- 1-phénylpropanone
- cyclopentanone
- diphénylcétone
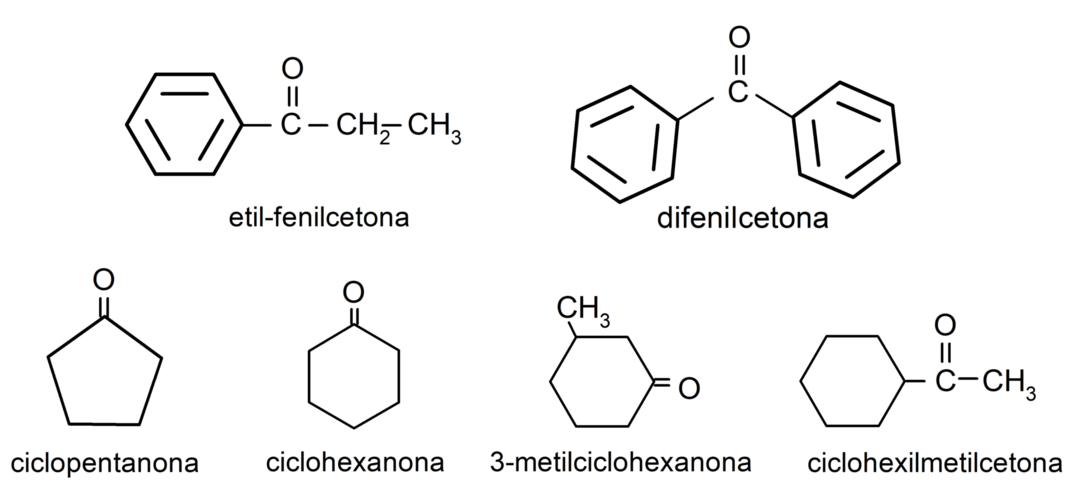
Utilisations des aldéhydes dans la vie quotidienne
Certaines utilisations des aldéhydes sont :
- Ils sont utilisés pour produire des solvants, des peintures, des parfums, des résines et des essences.
- Ils sont utilisés comme conservateurs dans les produits cosmétiques, les échantillons biologiques et les cadavres. Le formaldéhyde est le plus utilisé à ces fins.
- Ils sont utilisés pour produire des plastiques qui permettent de remplacer des pièces métalliques dans l’industrie automobile.
- Ils sont utilisés comme arômes pour certains aliments.
- Ils sont utilisés comme agents désinfectants.
- Ils ont été utilisés pour fabriquer certains explosifs, comme le tétranitrate de pentaérythritol (TNPE).
Utilisations des cétones dans la vie quotidienne
Certaines utilisations des cétones sont :
- Ils sont utilisés dans la production de solvants. L'acétone est particulièrement utilisée pour éliminer les peintures et les laques.
- Ils sont utilisés dans la fabrication de certains caoutchoucs et lubrifiants.
- Ils sont utilisés pour produire des peintures, des laques et des vernis.
- Ils sont utilisés pour produire des médicaments et des cosmétiques.
Toxicité des aldéhydes et des cétones
- Les aldéhydes. Le contact avec les aldéhydes provoque une irritation de la peau, des yeux et des voies respiratoires. De plus, l’exposition aux aldéhydes a été associée à des maladies telles que le cancer, la dermatite de contact et les maladies hépatiques et neurodégénératives. Le formaldéhyde, par exemple, est considéré par l'OMS (Organisation Mondiale de la Santé) comme un composé cancérigène.
- cétones. Une exposition répétée aux cétones peut endommager le système nerveux central. Cela peut entraîner une perte de mémoire, une faiblesse, des douleurs musculaires et des crampes. De plus, si la peau entre en contact avec des cétones, une sécheresse et des gerçures apparaissent. En revanche, si des cétones sont inhalées, une irritation des voies respiratoires et une toux surviennent.
Les références
- Llorens Molina, JA. (2018). “Aldéhydes et cétones: Quelques exemples.” http://hdl.handle.net/
- Gabriel Pinto Cañón, Manuela Martín Sánchez, José María Hernández Hernández, María Teresa Martín Sánchez (2015) «Le réactif de Tollens: de l'identification des aldéhydes à leur utilisation en nanotechnologie. Aspects historiques et applications didactiques.»Vol. 111 Non. 3. Société Royale Espagnole de Chimie.
- William Bauer, Jr. (2000) «Acide méthacrylique et dérivés» dans l'Encyclopédie Ullmann de chimie industrielle 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441.
- « Ils révèlent un nouveau mécanisme de toxicité dans un groupe de composés cancérigènes issus de l'alimentation et de l'environnement » (2022) Dans: www.conicet.gov.ar Disponible en: https://www.conicet.gov.ar/ Consulté: 20 juin 2023.
Suivre avec:
- Alcools
- Sucres
- Alcanes
