20 exemples d'amides
Exemples / / November 06, 2023
Le amides ils sont composés chimiques organiques dérivés d'acides carboxyliques, où le groupe hydroxyle (-OH) du groupe carboxyle (-COOH) de l'acide est remplacé par un groupe amino (-NH2, -NH-R, -N-(R)2, R étant n'importe quelle chaîne carbonée).
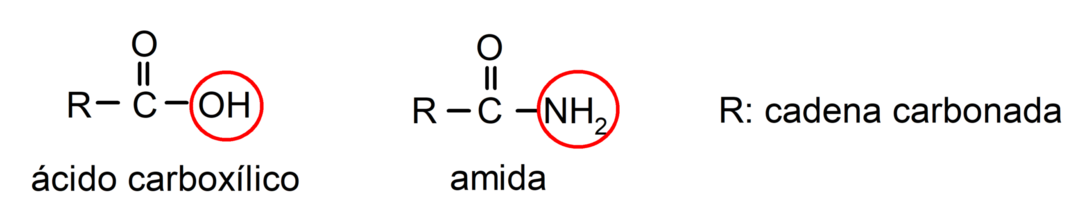
Les amides sont molécules organiques qui contiennent le groupe amide, qui est composé d’un groupe carbonyle et d’un groupe amino. Par exemple: l'étanamide, le propanamide et le N-méthyl-éthanamide.

- Voir également: Aldéhydes et cétones
Types d'amides
Les amides peuvent être classés en fonction du nombre d'hydrogènes (qui sont attachés à l'azote du groupe amino) qui ont été remplacés par différents groupes substituants. En ce sens, il existe des amides primaires, secondaires et tertiaires.
- Amides primaires. Ce sont des amides dont les hydrogènes du groupe amino ne sont pas substitués. Par exemple:

- Amides secondaires. Ce sont des amides dont l'un des hydrogènes du groupe amino est substitué. Par exemple:

- Amides tertiaires. Ce sont des amides dont deux des hydrogènes du groupe amino sont substitués. Par exemple:

Nomenclature des amides
Selon la nomenclature courante, les amides sont nommés dérivés d'acides carboxyliques selon les règles suivantes :
- Le carbone correspondant au groupe carbonyle est situé en position 1 et parmi ce carbone est choisie la chaîne carbonée la plus longue. Par exemple:

- Les amides primaires sont nommés en utilisant le préfixe correspondant au nombre d'atomes de carbone de l'acide carboxylique qui les a donnés naissance. Par exemple:

Selon l'Union internationale de chimie pure et appliquée (IUPAC), amines Ils sont nommés selon les règles suivantes :
- Les amides secondaires et tertiaires sont nommés en utilisant le préfixe correspondant au nombre d'atomes de carbone de l'acide carboxylique qui les a donnés naissance. De plus, pour chaque hydrogène du groupe amino substitué, un N est placé. Ainsi, les différents substituants sont nommés indiquant leur quantité et à la fin du nom est placé le mot amide. Par exemple:

- Lorsque la molécule a des groupes prioritaires par rapport au groupe amide, alors l'amide est nommé substituant. Dans ces cas, le groupe amide est appelé carbamoyl. Par exemple:
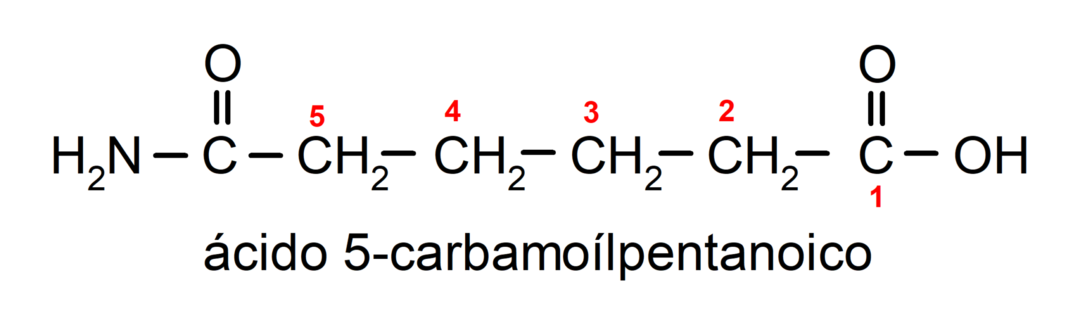
- Lorsque la molécule est formée d'un cycle et d'un groupe amide, le cycle est pris comme chaîne principale et le suffixe -carboxamide est placé. Par exemple:

Propriétés physiques des amides
- Les amides sont solides à température ambiante, à l'exception du méthanamide.
- Ils ont des points d'ébullition élevés, même supérieurs à ceux des acides carboxyliques correspondants.
- Les amides sont de bons solvants.
- Ce sont des bases faibles.
Réactions chimiques des amides
- Les amides réagissent avec un acide aqueux pour former l'acide carboxylique correspondant et un sel d'ammonium. Par exemple:

- Les amides réagissent avec les alcalis pour former l'acide carboxylique correspondant et un sel carboxylate. Par exemple:
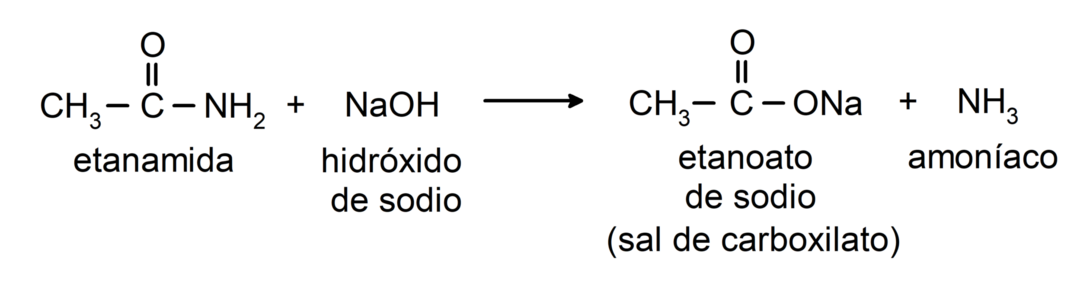
- Les amides sont réduits en amines en présence de tétrahydrure de lithium et d'aluminium :
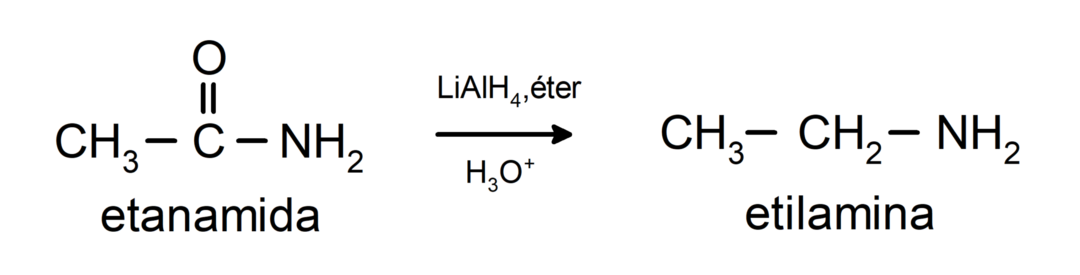
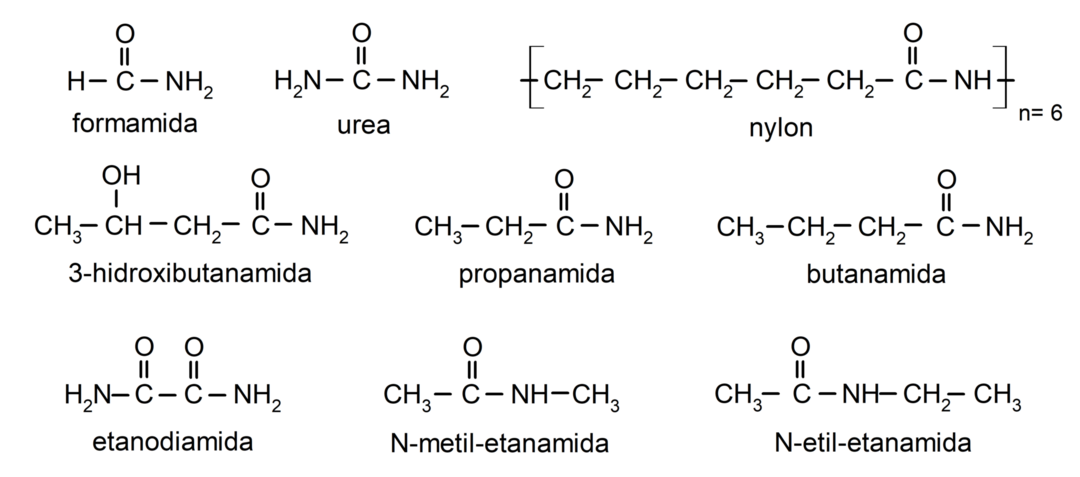
Exemples d'amides
- formamide
- urée
- nylon
- ε-caprolactame
- étanamide
- propanamide
- butanamide
- éthanediamide
- N-méthyl-éthanamide
- N-éthyl-éthanamide
- N-propyl-éthanamide
- N, N-diméthyl-butanamide
- benzènecarboxamide
- 4-bromo-3-méthyl-cyclohexanecarboxamide
- 3-hydroxybutanamide

Utilisations des amides
Les amides sont largement utilisés dans l'industrie pharmaceutique. De plus, ils sont utilisés comme composants de démoulage dans l’industrie du plastique. D’autre part, ils sont utilisés comme émulsifiants, tensioactifs et solvants. Par exemple, l’urée est un amide largement utilisé dans l’industrie pharmaceutique et dans l’industrie du nylon.
Les références
- Ramírez-Barrón, S. N., Sáenz-Galindo, A., López-López, L. et Cantú-Sifuentes, L. (2013). Amides, application et synthèse. Revue scientifique de l'Université autonome de Coahuila, 5(9).
- Caglieri, S. C., & Pagnan, M. (2013). Etude théorique sur l'hydrolyse acide des amides aliphatiques et aromatiques. Informations technologiques, 24(3), 35-40.
- Martinez, C. H. M., Gomez, L. ET. P., de Escobar, M. S. et Escalante, F. À. (2002). Chimie organique. Université de Las Palmas de Gran Canaria, Vice-Rectorat des Études et de la Qualité de l'Enseignement.
Suivre avec:
- Aldéhydes
- Alcools
- Macronutriments et micronutriments
- Composés organiques et inorganiques

