20 exemples d'amines
Exemples / / November 06, 2023
Le amines ils sont composés chimiques organiques dérivés de l'ammoniaque (NH3), où au moins un des hydrogènes de l'ammoniac a été remplacé par un groupe alkyle ou aryle, entraînant la formation d'un groupe amino (-NH2, -NH-, -N=). Par exemple:méthylamine, éthylamine et propylamine.

Un groupe alkyle est un substituant qui se forme lorsqu'un hydrogène est éliminé d'un hydrocarbure saturé. De cette façon, le carbone dont cet hydrogène a été séparé peut se lier à un autre atome. Par exemple: méthyle (CH3 -) et éthyle (CH3 –CH2 -).
Un groupe aryle est un substituant dérivé d'un cycle aromatique, tel que le benzène. Par exemple: phényle (C6h5 -)
- Voir aussi: Amides
Types d'amines
Les amines peuvent être classées selon le nombre d'atomes d'hydrogène liés à l'azote qui ont été remplacés par des groupes fonctionnels alkyle ou aryle.
Selon ce critère, il y a :
- amines primaires. Ils se forment lorsqu'un seul des atomes d'hydrogène de l'ammoniac est remplacé par un groupe alkyle ou aryle. Par exemple: l'éthylamine et la 1-pentylamine.
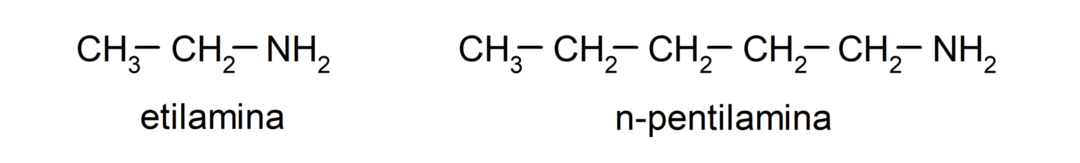
- amines secondaires. Ils se forment lorsque deux des atomes d’hydrogène de l’ammoniac sont remplacés par un groupe alkyle ou aryle. Par exemple: diéthylamine et éthylméthylamine.
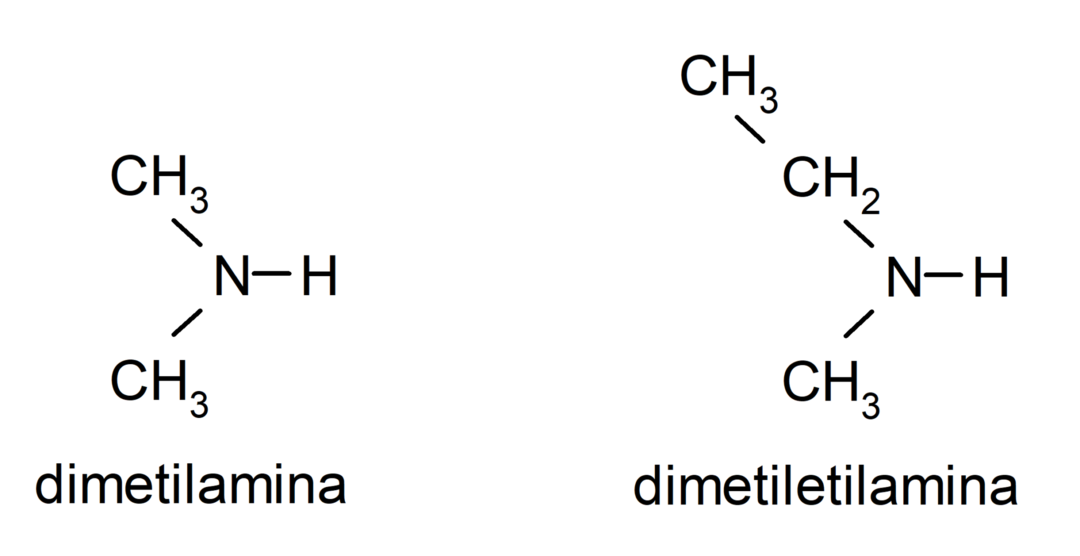
- Amines tertiaires. Ils se forment lorsque les trois atomes d'hydrogène de l'ammoniac sont remplacés par un groupe alkyle ou aryle. Par exemple: triméthylamine et diméthyléthylamine.
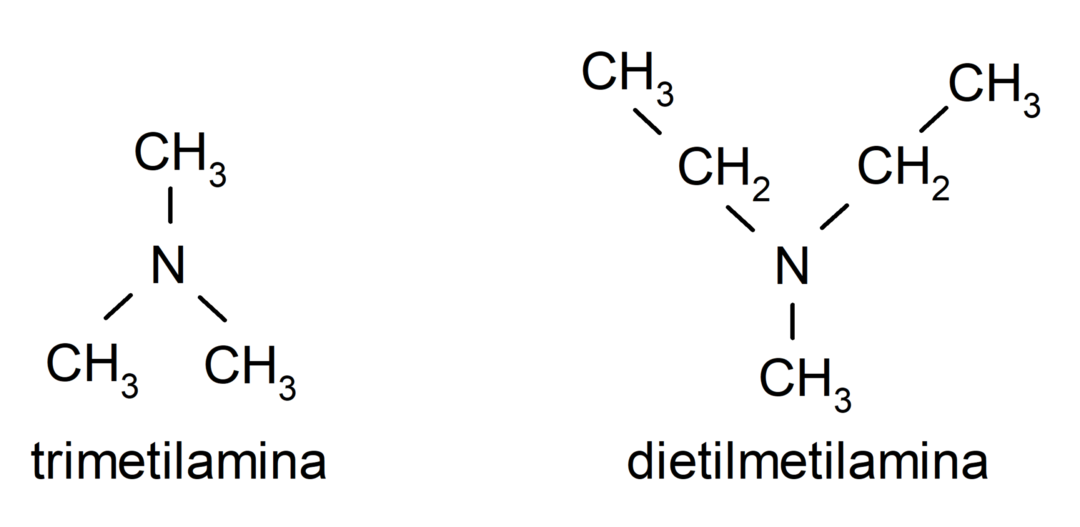
Les amines sont également classées en fonction du type de groupe lié à l'azote. Selon ce critère, il y a :
- Amines aliphatiques. Ils ont des substituants alkyle. Par exemple: butylamine et diéthylamine.

- amines aromatiques. Ils ont des substituants aryles. Par exemple: phénylamine (aniline) et diphénylamine.
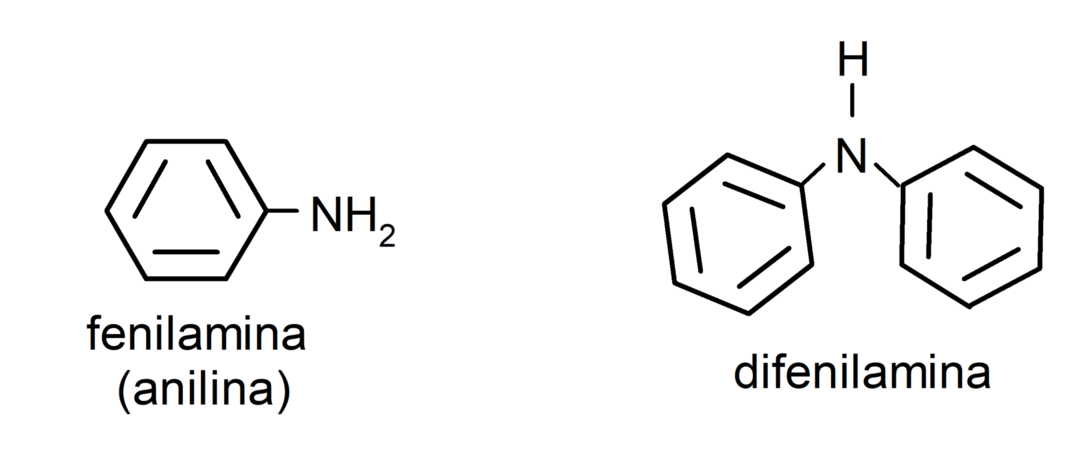
Nomenclature des amines
Selon l'IUPAC (Union Internationale de Chimie Pure et Appliquée), les amines sont nommées selon les règles suivantes :
Pour les amines les plus simples, chacun des substituants des groupes hydrogène liés à l’azote ammoniacal est nommé. Ensuite, le mot « amine » est placé à la fin du nom.
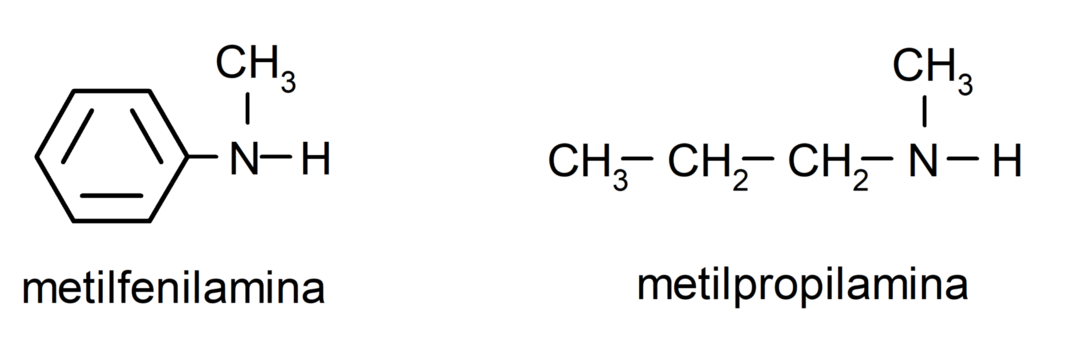
Pour les amines qui contiennent plusieurs chaînes carbonées (qui, à leur tour, ont d'autres substituants), la chaîne carbonée qui contient le groupe amino est choisie comme chaîne principale. De plus, la position du groupe amino est choisie de manière à ce qu'il occupe la plus petite position dans la chaîne carbonée, et en En fonction de cette position, les substituants sont également choisis de manière à occuper la position la plus petite possible dans le chaîne.
Enfin, ils sont nommés en utilisant le nom de l'alcane, de l'alcène ou de l'alcyne correspondant pour la chaîne principale, et le suffixe amine est placé.
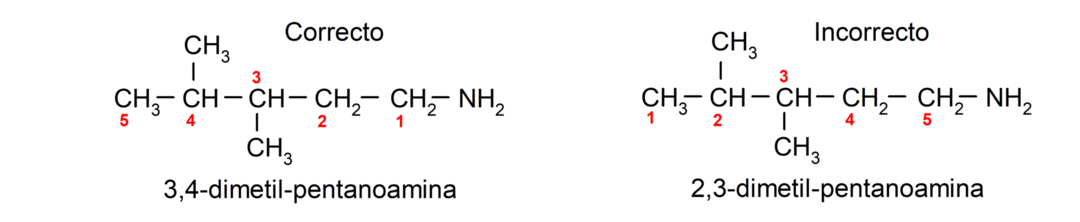
Si la chaîne carbonée contient plusieurs groupements aminés, ceux-ci sont choisis à la position qu'ils occupent dans la plus petite combinaison de la numérotation de leurs positions. De plus, le nom de l'alcane, de l'alcène ou de l'alcyne correspondant est placé, suivi du terme qui indique le nombre de groupes amino, suivi du suffixe « amine ».

Propriétés physiques des amines
Les propriétés physiques des amines dépendent en grande partie du nombre d'hydrogènes attachés à l'azote qui ont été substitués et du type de substituants par lesquels ils ont été substitués.
- Solubilité. En général, les amines sont plus solubles dans l'eau que les hydrocarbures saturés correspondants. De plus, les amines à longues chaînes carbonées sont moins solubles dans l’eau que les amines à chaînes carbonées courtes. En revanche, les amines aromatiques ne sont pas solubles dans l’eau.
- Point d'ébullition. Le point d’ébullition des amines est supérieur à celui des alcanes ayant le même nombre d’atomes de carbone.
- Odeur. La plupart des amines ont des odeurs désagréables. Par exemple, la putrescine sent la viande pourrie et la triméthylamine sent le poisson pourri.
Propriétés chimiques des amines
Certaines propriétés chimiques des amines sont :
- Ce sont des composés chimiques de base, c'est-à-dire qu'ils subissent des réactions au cours desquelles ils acceptent des protons selon la théorie de Brønsted-Lowry. Par exemple:
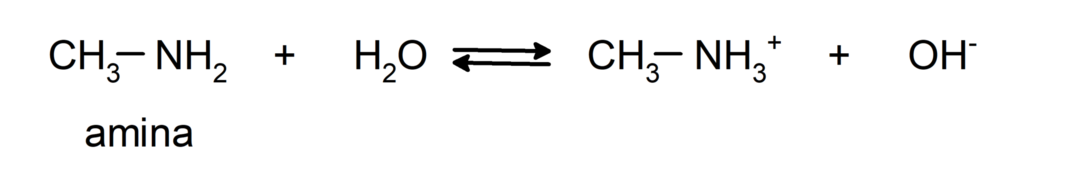
- Ils présentent des réactions de neutralisation avec des acides dans lesquels se forment des sels d'amines. Par exemple:

Exemples d'amines
- méthylamine
- éthylamine
- propylamine
- diméthylamine
- éthylméthylamine
- phénylamine (aniline)
- diphénylamine
- méthylpropylamine
- butane-1,4-diamine
- spermine
- cadavérine
- 3,5-diméthylaniline
- méthylaniline
- amphétamine
- pipérazine


Fonction biologique des amines
Les amines sont présentes dans de nombreux êtres vivants et remplit diverses fonctions. Certaines amines, comme l'épinéphrine, la noradrénaline, la sérotonine et la dopamine, sont des neurotransmetteurs.
Le groupe amino est l'un des groupes fonctionnels qui forment les acides aminés, qui sont les unités fondamentales de protéines. De plus, les bases azotées qui composent l’ADN et l’ARN contiennent des groupes aminés.
Utilisations des amines
Certaines utilisations des amines sont :
- Ils sont utilisés pour produire des composés agrochimiques et pharmaceutiques.
- Ils sont utilisés comme catalyseurs dans la production de polyuréthanes.
- En raison de leur effet amortisseur, ils sont utilisés pour inhiber la corrosion dans les environnements aqueux.
- Ils sont utilisés pour purifier les gaz dans les centrales électriques et les raffineries.
- Ils sont utilisés pour fabriquer des produits de nettoyage.
- Ils sont utilisés dans la fabrication de produits de soins personnels, car ils améliorent la mousse des savons et des shampoings.
Toxicité aux amines
L'inhalation d'amines à des concentrations élevées provoque une intoxication, qui à son tour provoque une augmentation de la pression artérielle et des convulsions. De plus, le contact avec des amines aliphatiques dans état gazeux provoque une irritation des yeux et des voies respiratoires. Plusieurs amines provoquent des brûlures cutanées au contact.
Les amines aromatiques sont très toxiques, mais comme elles sont beaucoup moins volatiles que les amines aliphatiques, leur contact peut être mieux contrôlé.
Les références
- Perez, C. R. C., & Jiménez-Colmenero, F. (2010). Amines biogènes: Importance toxicologique. Électron. J. Bioméd., 3, 58-60.
- Fernández García, M., et Álvarez González, M. Á. (2005). Amines biogènes dans les aliments.
Suivre avec:
- Alcools
- Aldéhydes
- L'alcool éthylique
- Chimie organique
