30 exemples d'alcools
Exemples / / November 06, 2023
Les alcools ils sont composés chimiques organiques qui contiennent dans leur structure la fonction hydroxyle (- OH) attachée à un carbone (- C). Le groupe (-C – OH) est appelé « carbinol ». Voici quelques exemples d’alcools : méthanol, éthanol et 1-propanol.
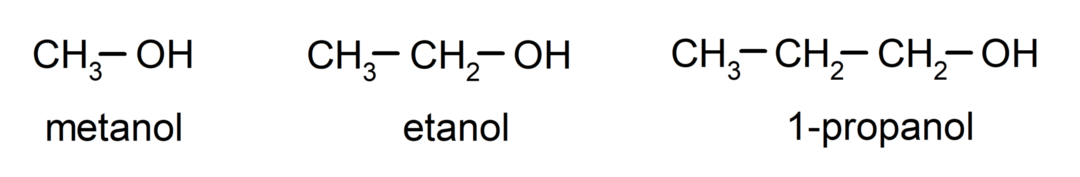
Les alcools sont des composés chimiques aux usages variés dans la vie quotidienne, car ils possèdent des propriétés antibactériennes et antiseptiques. En revanche, ils peuvent être dangereux pour la santé humaine en cas d’ingestion incontrôlée.
De même, tous les alcools ne peuvent pas être ingérés par les humains.
- Voir aussi: Amines et cétones
Types d'alcools
En fonction du nombre d'atomes de carbone auxquels est attaché l'atome de carbone auquel est attaché le groupe hydroxyle, un alcool peut être :
- Alcool primaire. L’atome de carbone auquel le groupe hydroxyle est attaché est également attaché à un seul atome de carbone. Par exemple:
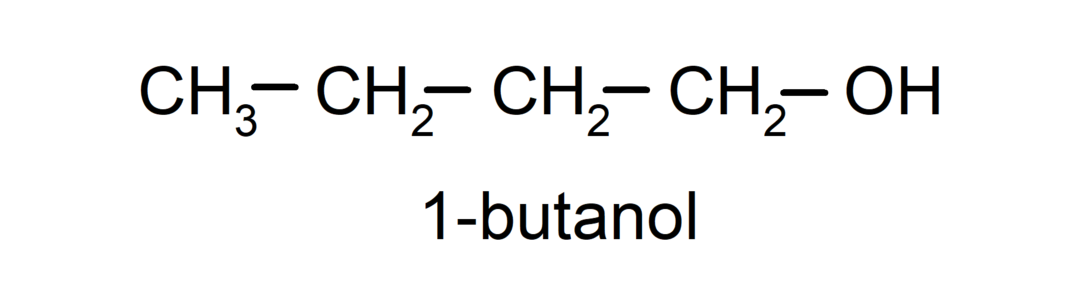
- Alcool secondaire. L’atome de carbone auquel est attaché le groupe hydroxyle est également lié à deux autres atomes de carbone. Par exemple:
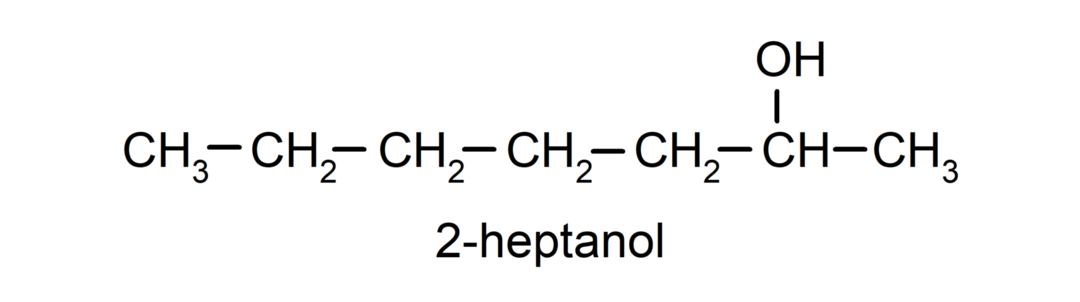
- Alcool tertiaire. L’atome de carbone auquel le groupe hydroxyle est attaché est également attaché à trois atomes de carbone. Par exemple:
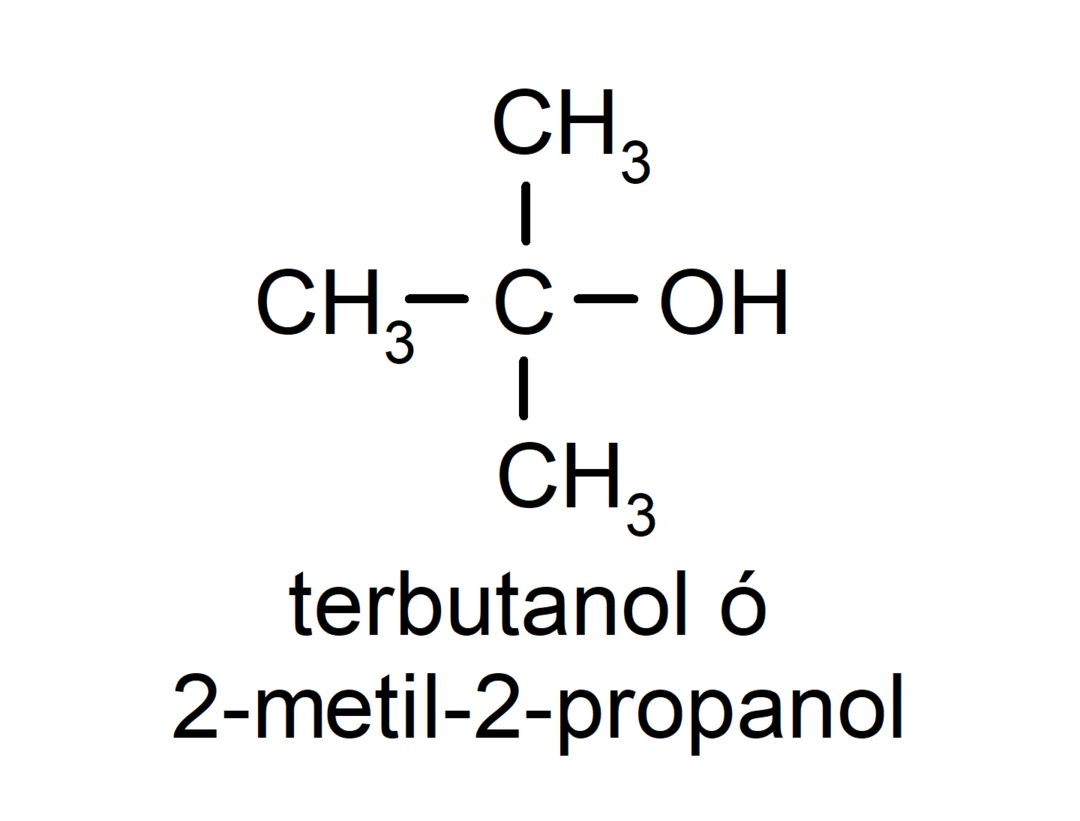
Selon le nombre de groupes hydroxyles qu'il possède, un alcool peut être :
- Diol. Il possède deux groupes hydroxyle dans sa structure. Par exemple:
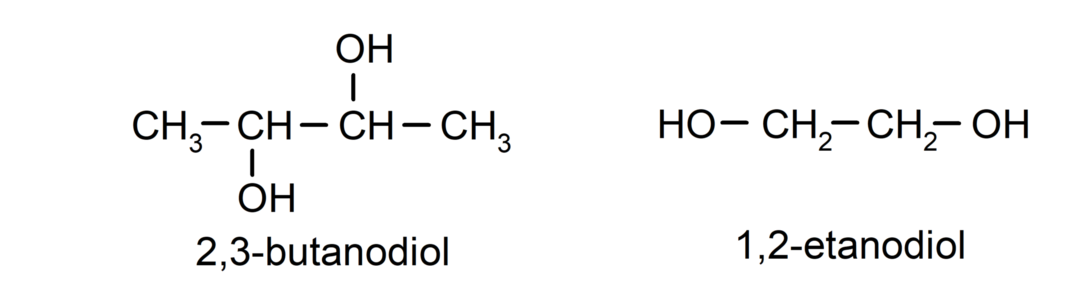
- Triol. Il possède trois groupes hydroxyle dans sa structure. Par exemple:
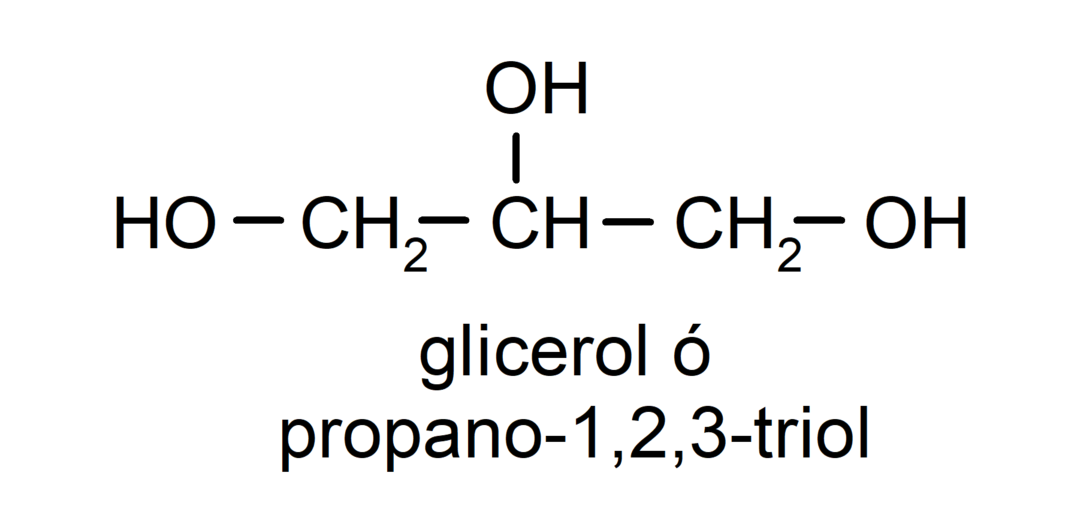
- Polyalcool. Il possède de nombreux groupes hydroxyle dans sa structure. Par exemple:
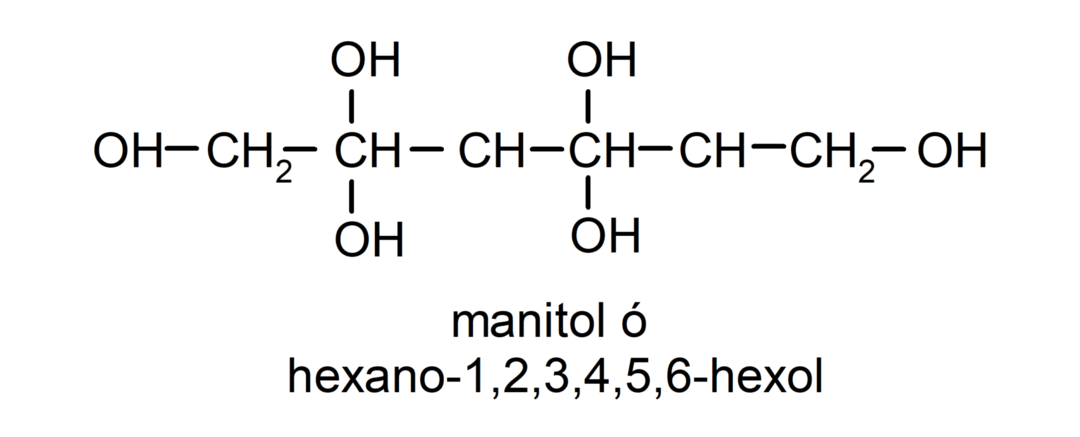
Propriétés physiques des alcools
Certaines des propriétés physiques des alcools sont :
- Point d'ébullition. Le point d'ébullition des alcools est assez élevé en raison de la présence du groupe hydroxyle, qui permet la formation de liaisons hydrogène. De plus, plus il y a de groupes fonctionnels hydroxyles dans la chaîne carbonée, plus le point d'ébullition d'alcools.
- Polarité. Les alcools sont des composés assez polaires.
- Solubilité. Les alcools de faible poids moléculaire sont solubles dans l'eau. En revanche, plus la chaîne carbonée des alcools est grande, plus leur solubilité dans l’eau est faible. De plus, plus les alcools ont de groupes hydroxyles, plus leur solubilité dans l’eau est grande.
- État d'agrégation. La plupart des alcools sont liquides à température ambiante (25°C) et ont des odeurs caractéristiques.
Propriétés chimiques des alcools
Certaines des propriétés chimiques des alcools sont :
- Les alcools se comportent comme des acides et des bases.. Leur comportement en tant qu'acides peut être observé dans des réactions avec des métaux actifs pour libérer de l'hydrogène gazeux et former des alcoxydes.

Leur comportement en tant que bases peut être observé dans des réactions telles que la réaction du méthanol avec le bromure d'hydrogène pour former du bromure de méthyloxonium.
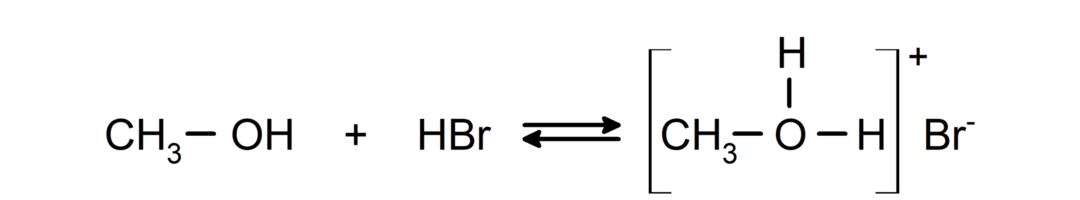
- Les alcools subissent des réactions d'halogénation. Ils réagissent avec les halogénures d'hydrogène pour former des halogénures d'alkyle.
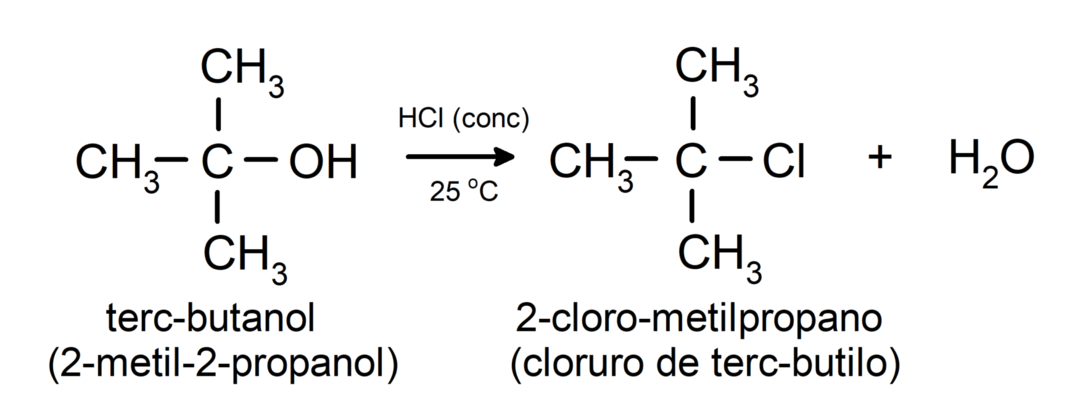
-
Les alcools subissent des réactions d'oxydation lorsqu'ils réagissent avec certains composés oxydants. Les produits des réactions d'oxydation dépendent du type d'alcool en réaction, c'est-à-dire s'il est primaire, secondaire ou tertiaire.
Oxydation de l'alcool primaire pour former de l'aldéhyde ou de l'acide carboxylique.
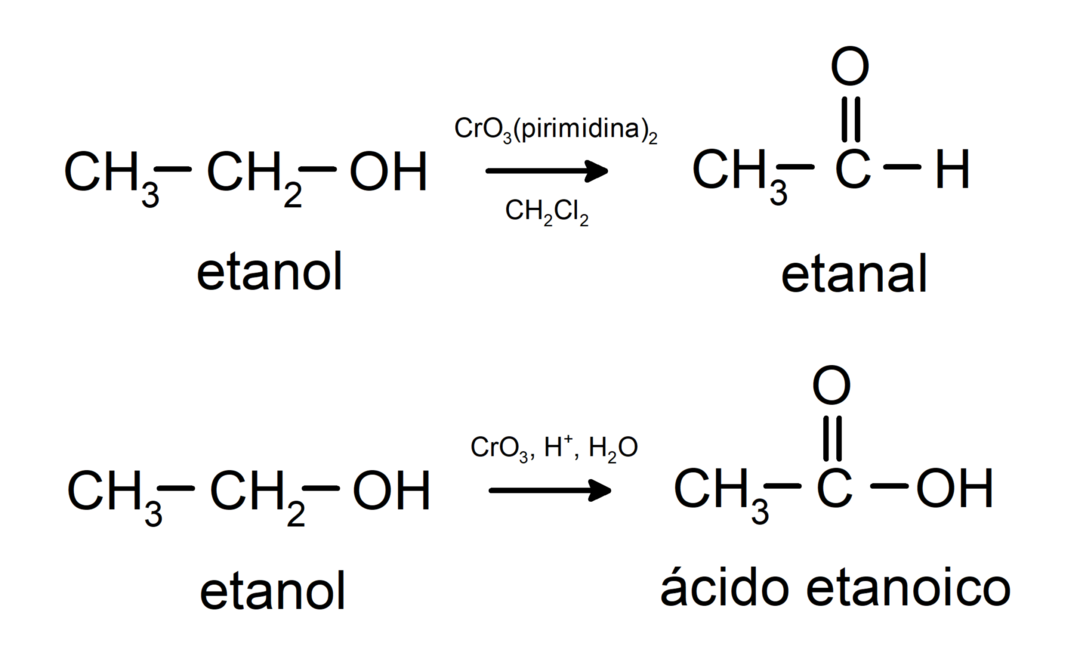
Oxydation de l'alcool secondaire pour former de la cétone.
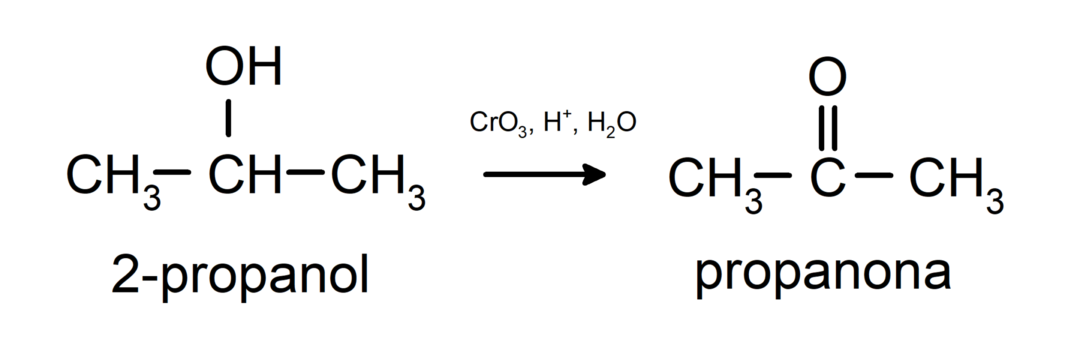
Les alcools tertiaires ne s'oxydent pas avec les oxydants courants. Avec des agents oxydants très puissants, ils peuvent être transformés en alcènes, qui peuvent ensuite être oxydés.
Les alcools qui ont deux groupes hydroxyle situés sur des carbones adjacents sont oxydés avec du tétraacétate de plomb pour former deux cétones.
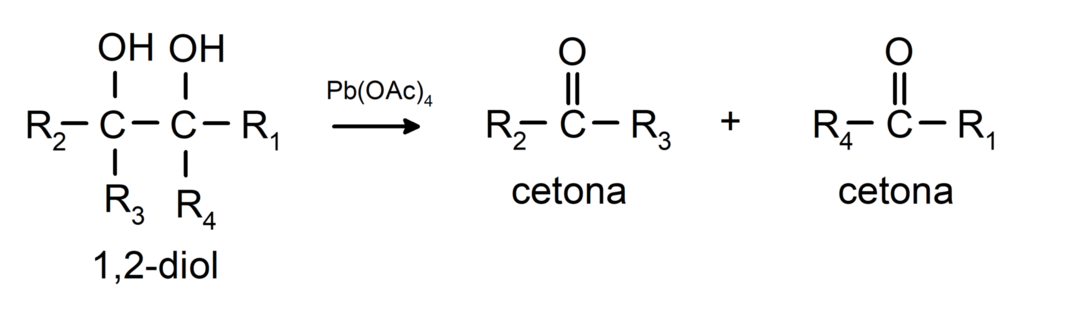
- Les alcools subissent des réactions de déshydrogénation. Ces réactions se produisent uniquement avec les alcools primaires et secondaires qui, soumis à des températures élevées en présence de catalyseurs, libèrent des hydrogènes.
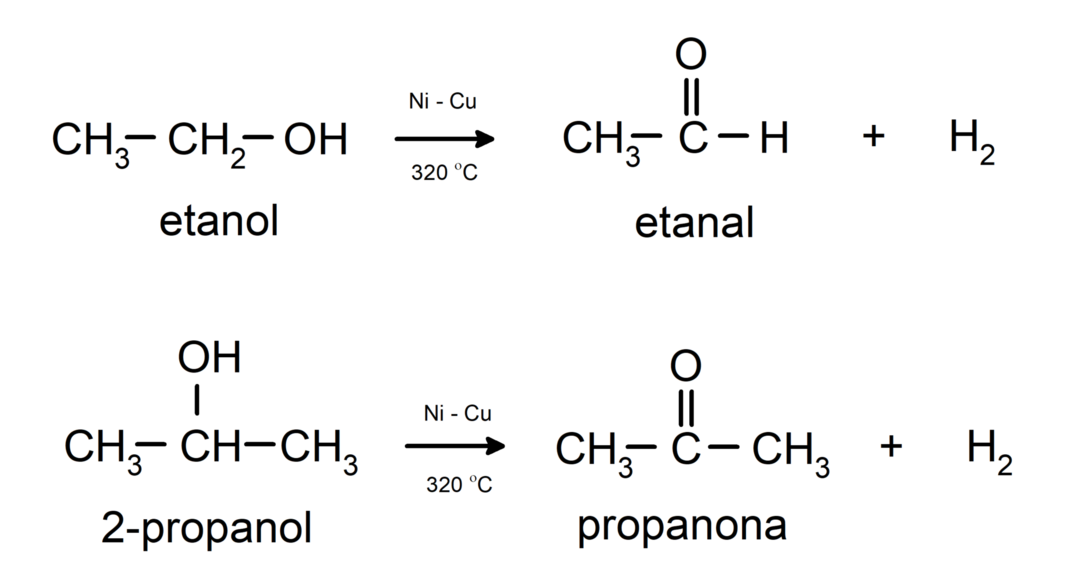
- Les alcools subissent des réactions de déshydratation. Les alcools se déshydratent pour former les alcènes correspondants. Cette réaction se produit en présence d’acides et de températures intermédiaires.
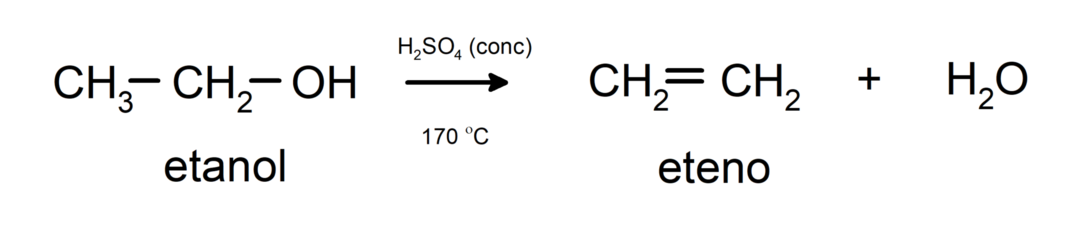
Nomenclature des alcools
Selon la nomenclature établie par l'IUPAC (Union Internationale de Chimie Pure et Appliquée), les alcools sont nommés selon les règles suivantes :
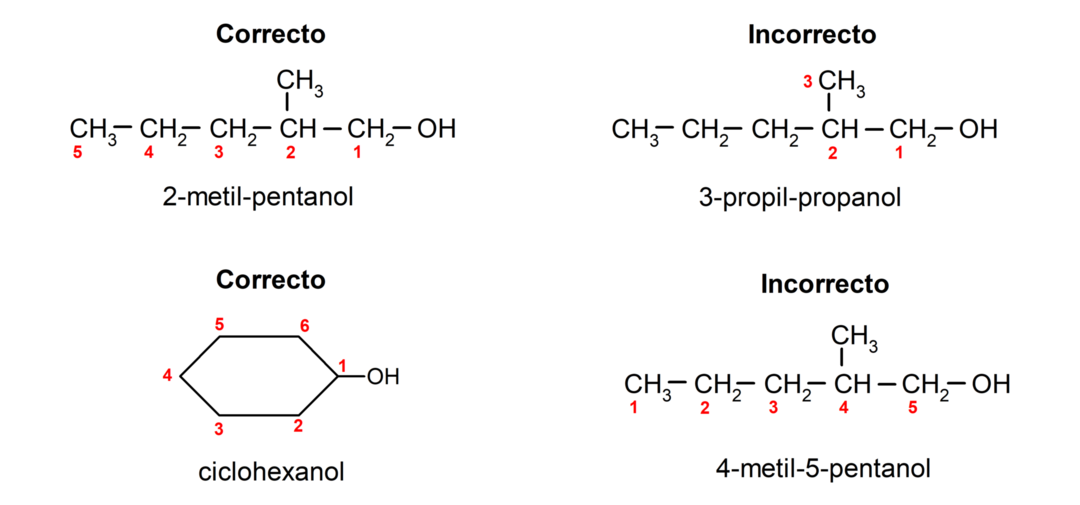
- La position du groupe hydroxyle est choisie en tenant compte du fait qu'il occupe le numéro le plus bas possible dans la chaîne carbonée. Si la structure de l'alcool est cyclique, la position 1 sur le carbone auquel est attaché le groupe hydroxyle est prise en compte et le préfixe cyclo- est utilisé pour le nommer.
- Le nom de l'alcool est écrit à l'aide de préfixes qui indiquent le nombre d'atomes dans la chaîne carbonée, et en plus, le suffixe -ol est placé.
- Si la structure de l'alcool présente des branches, la chaîne la plus longue contenant également le groupe hydroxyle est choisie comme chaîne carbonée principale.
Selon la nomenclature traditionnelle, les alcools sont nommés en écrivant le mot « alcool », puis en écrivant le nom de l'alcool. alcane correspondant à la chaîne carbonée, mais au lieu d'utiliser la terminaison -ane de l'alcane, la terminaison -yllique.
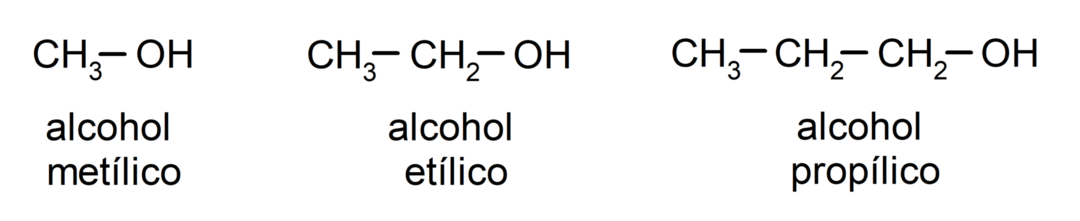
Exemples d'alcools
- méthanol
- éthanol
- 1-propanol
- 2-propanol
- 1-butanol
- 3-éthylhexan-2-ol
- glycérol
- phénol
- 2-méthyl-2-butanol
- 1,2-éthanediol
- 1,5-heptadiène-3-ol
- 3-méthyl-2-butanol
- benzylméthanol
- 3-pentanol
- 2-méthylphénol
- 1,2-dihydroxyphénol
- cyclohéaxnol
- 1-phényléthanol


Utilisations des alcools
Les utilisations les plus courantes des alcools sont :
- Ils sont utilisés comme désinfectants et antiseptiques car ils stoppent la croissance de certains micro-organismes ou les détruire. L'éthanol et l'alcool isopropylique sont les plus utilisés à cet effet.
- Ils sont utilisés dans la synthèse de différents composants chimiques. Le méthanol, par exemple, est utilisé pour obtenir du méthanal (formaldéhyde).
- Ils sont utilisés pour produire de l'antigel. Le méthanol est l’un des plus utilisés à cette fin.
- Ils sont utilisés comme solvants dans l'industrie pharmaceutique. L'éthanol est l'un des plus utilisés dans ce sens.
- Ils sont utilisés comme solvants pour les laques, les colorants et les encres. Le méthanol est largement utilisé à cette fin.
- Ils sont utilisés comme combustible et il existe une tendance importante à remplacer partiellement l'utilisation de combustibles fossiles par l'utilisation de carburant bioéthanol.
- Ils sont utilisés pour fabriquer des résines. Le phénol est utilisé dans ce sens.
Les dangers de la consommation d'alcool
Bien que la consommation d’alcool soit aujourd’hui socialement acceptée, l’abus de cette substance génère dépendance et addiction.
L'éthanol est l'alcool présent dans les boissons alcoolisées qui, lorsqu'il est consommé en excès, affecte capacités cognitives et peut provoquer des maladies cardiovasculaires, une cirrhose du foie et cancer.
En outre, lorsque le degré d'intoxication alcoolique est atteint, c'est-à-dire l'état d'ivresse, si la dose du médicament est l'alcool est trop élevé, un coma alcoolique peut survenir, pouvant entraîner une paralysie respiratoire, voire la mort. la mort.
Les références
- T. À. Geissman. (1974) « Principes de chimie organique » Deuxième édition. Éditorial Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E. et Valdez-Montero, C. (2017). La consommation d'alcool comme problème de santé publique. Ra Ximhai, 13(2), 13-24.
- Morrison, R. T. et Boyd, R. N. (1998). Chimie organique. Éducation Pearson.
- Weininger, S. J. et Stermitz, F. R. (1988). Chimie organique. J'ai inversé.
Suivre avec:
- L'alcool éthylique
- Carburants
- Chimie organique
