30 exemples de ventes binaires
Exemples / / November 09, 2023
Le sels binaires (sels neutres) se forment lorsqu'un métal et un non-métal se combinent. Ils sont composants chimiques composé de seulement deux éléments chimiques. Par exemple: chlorure de sodium (NaCl) et bromure de potassium (KBr).
- Voir également: Métaux et non-métaux
Exemples de sels binaires
- Chlorure de sodium (NaCl)
- Chlorure de fer (II) (FeCl2)
- Chlorure de fer (III) (FeCl3)
- Sulfure de cobalt (II) (CoS)
- Sulfure de cobalt(III) (Co2Oui3)
- Sulfure de plomb (II) (PbS)
- Sulfure de plomb (IV) (PbS2)
- Chlorure de calcium (CaCl2)
- Fluorure de sodium (NaF)
- Chlorure de lithium (LiCl)
- Chlorure de strontium (SrCl2)
- Chlorure de baryum (BaCl2)
- Chlorure d'aluminium (AlCl3)
- Sulfure de magnésium (MgS)
- Chlorure de rubidium (RbCl)
- Bromure de calcium (CaBr2)
- Sulfure de potassium (K2S)
- Bromure de magnésium (MgBr2)
- Sulfure de zinc (Zn2S)
- Bromure de lithium (LiBr)
- Chlorure de nickel (NiCl2)
- Chlorure d'uranium (III) (UCl3)
- Bromure d'argent (AgBr)
- Iodure d'argent (AgI)
- Bromure de potassium (KBr)
Nomenclature des sels binaires
Selon la nomenclature traditionnelle, les sels binaires sont nommés en écrivant le nom de l'élément non métallique avec la terminaison -ide. En revanche, le nom de l’élément métallique s’écrit en fonction de son état d’oxydation :
- Pour l’état d’oxydation le plus bas, il s’écrit avec la terminaison –oso. Par exemple: chlorure ferreux (FeCl2), où le fer a un état d’oxydation de 2+.
- Pour l’état d’oxydation le plus élevé, il s’écrit avec la terminaison -ico. Par exemple: chlorure ferrique (FeCl3), où le fer a un état d’oxydation de 3+.
Selon la nomenclature systématique, les sels binaires sont nommés en écrivant le nom de l'élément non métallique avec un préfixe qui indique la quantité de atomes de cet élément dans le composé. De plus, la terminaison -uro est placée au nom de l'élément non métallique. Ensuite, le nom de l’élément métallique est placé. Par exemple: dichlorure de magnésium (MgCl2) et du trichlorure de fer (FeCl3).
Selon la nomenclature de Stock, les sels binaires sont nommés en écrivant le nom de l'élément non métallique avec la terminaison -ide. Ensuite, le nom de l'élément métallique est placé suivi de son état d'oxydation écrit en chiffres romains et entre parenthèses. Par exemple: chlorure de fer(II) (FeCl2) et le sulfure de cobalt (III) (Co2Oui3).
Applications des sels binaires
- Ils sont utilisés comme réfrigérants dans les industries alimentaire et pharmaceutique. Par exemple: chlorure de calcium (CaCl2).
- Ils sont utilisés pour traiter les surfaces métalliques contre la corrosion. Par exemple: fluorure de sodium (NaF).
- Ils sont utilisés pour réguler l’humidité dans l’industrie du papier et de la construction. Par exemple: chlorure de calcium (CaCl2).
- Ils sont utilisés dans l’industrie du verre pour éliminer les impuretés. Par exemple: tétrachlorure de silicium (SiCl4).
- Ils sont utilisés comme ingrédients de cuisine. Par exemple: chlorure de sodium (NaCl).
Propriétés physiques des sels binaires
- Ils ont des points de fusion élevés car ils sont constitués de des liaisons ioniques.
- Ils conduisent le courant électrique lorsqu'ils sont dissous ou fondus.
- Les sels les plus courants ont une faible dureté.
- Ils ne sont pas compressibles.
- La plupart peuvent se dissoudre dans l’eau.
Comment obtient-on les sels binaires ?
Les sels binaires peuvent être obtenus par certaines des réactions chimiques suivantes :
Réaction entre un métal et un non-métal. Par exemple: la réaction entre le sodium (Na) et le dichlorure (Cl2) produit du chlorure de sodium (NaCl).
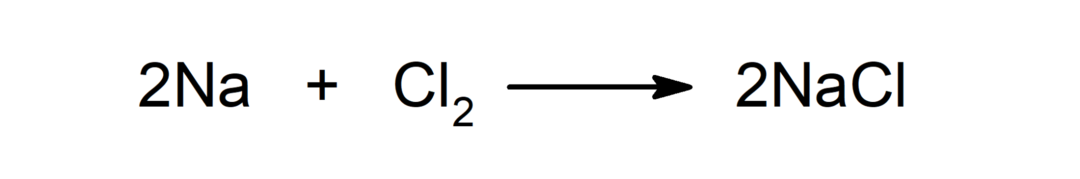
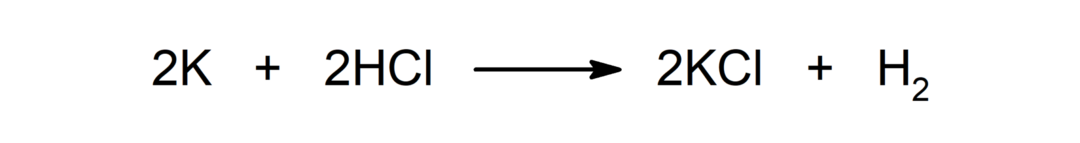
Réaction entre un métal et un acide. Par exemple: La réaction entre le potassium (K) et l'acide chlorhydrique (HCl) produit du chlorure de potassium (KCl) et du dihydrogène (H2).
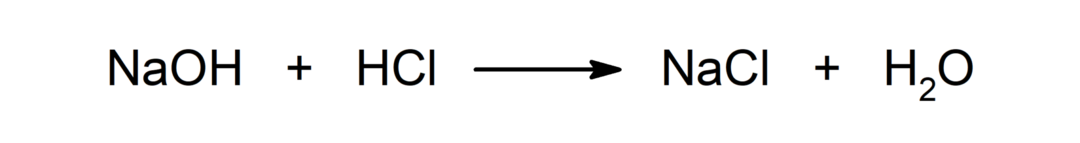
Réaction entre un acide et une base. Par exemple: La réaction entre l'acide chlorhydrique (HCl) et l'hydroxyde de sodium (NaOH) produit du chlorure de sodium (NaCl) et de l'eau (H2SOIT).
Suivre avec:
- oxysels
- sels neutres
- sels acides
Les références
- Cerón Villalba, A., Novoa Ramírez, C. S. et Alpizar Juárez, E. (2020). Vidéo de nomenclature 1: sels binaires et réaction chimique.
- Acurio Arias, M. V., & Delgado Méndez, M. ET. (2022). Guide d'apprentissage par le jeu des « composés binaires » en chimie au lycée de l'unité pédagogique « Herlinda Toral » (Thèse de licence, Université nationale d'éducation).
- Cabrera, M. J. H. (2005). Etude à partir des premiers principes des propriétés électroniques et structurales des composés binaires et ternaires (Thèse de doctorat, Université de La Laguna).

