Exemples de réactions endothermiques
Exemples / / November 09, 2023
Ongle réaction endothermique C'est une réaction qui absorbe l'énergie du milieu sous forme de chaleur. Dans ces réactions, pour que les réactifs se transforment en produits, il est nécessaire qu’ils absorbent de la chaleur, ce qui fait que les produits ont plus d’énergie que les réactifs qui les ont donnés. Voici quelques exemples de réactions endothermiques: la photosynthèse et l'électrolyse de l'eau.
- Voir également: Réactions chimiques
Exemples de réactions endothermiques dans la vie quotidienne
Certaines des principales réactions endothermiques sont :
Production d'ozone dans l'atmosphère. L'ozone est produit dans l'atmosphère lorsque l'oxygène moléculaire (O2) absorbe le rayonnement ultraviolet et se décompose. Alors un atome d'oxygène (O) peut interagir avec une autre molécule d'oxygène (O2) et forment de l'ozone (O3).

Électrolyse de l'eau. C'est le processus par lequel il est appliqué énergie électrique à l'eau pour la séparer en ses deux composants, l'hydrogène (H) et l'oxygène (O).
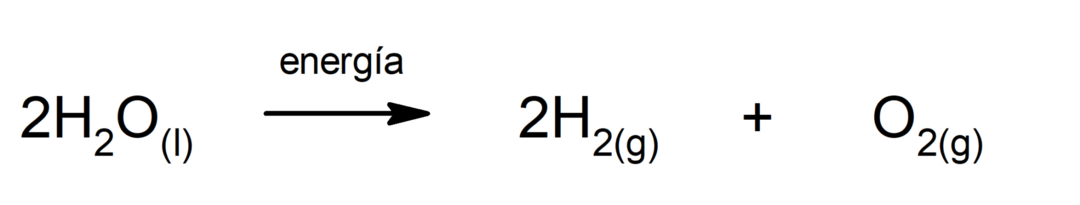
Photosynthèse
. C'est la réaction chimique par laquelle, en absorbant énergie solaire, dioxyde de carbone (CO2) est transformé en glucose. Cette réaction constitue la principale voie de nutrition des plantes.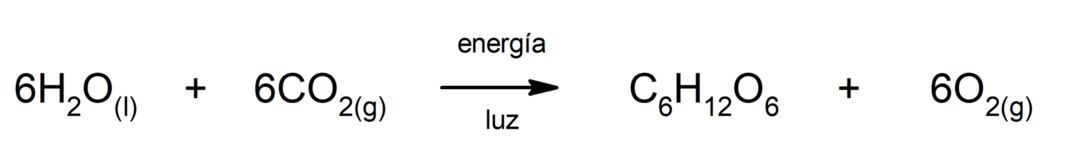
Production de sulfure de fer (II). Pour que la réaction entre le soufre et le fer se produise, il est nécessaire d’apporter de l’énergie sous forme de chaleur.
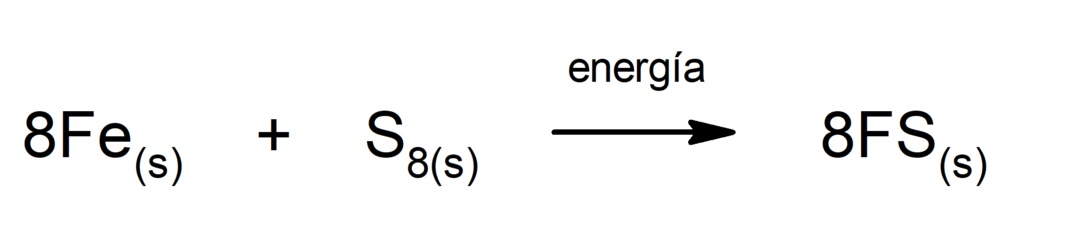
Décomposition du dioxyde de carbone (CO2). La décomposition du CO2 À haute température, il produit du monoxyde de carbone (CO) et de l'oxygène (O2).
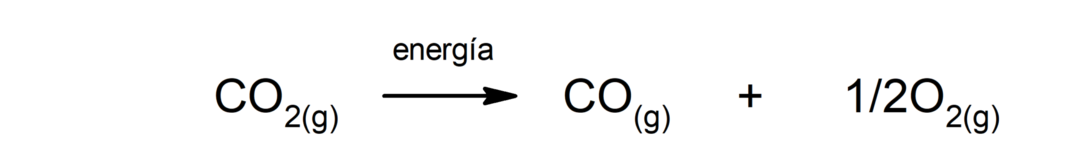
Décomposition du carbonate de calcium (CaCO3). Le carbonate de calcium se décompose par absorption de chaleur pour produire de l'oxyde de calcium (CaO) et du dioxyde de carbone (CO).2).
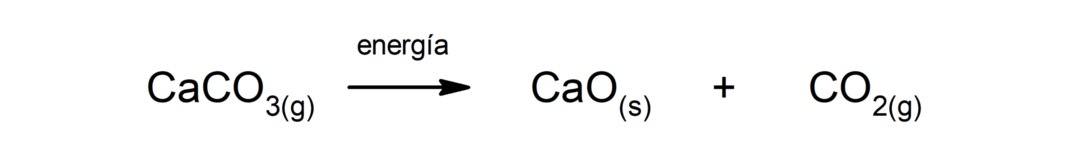
Différence entre réaction endothermique et exothermique
La principale différence entre les réactions endothermiques et exothermiques réside dans le fait que les réactions endothermiques absorbent de la chaleur, tandis que les réactions exothermiques libèrent de la chaleur.
De plus, les réactions endothermiques sont caractérisées par une augmentation de l'enthalpie, tandis que les réactions exothermiques sont associées à une diminution de l'enthalpie.
L'enthalpie est une grandeur thermodynamique qui définit le flux d'énergie thermique à pression constante lors d'une réaction chimique. Elle est représentée par la lettre H, et sa variation est l'un des principaux indicateurs pour définir si une réaction chimique est endothermique ou exothermique.
- Si une réaction chimique a un changement d'enthalpie supérieur à zéro (ΔH > 0) est endothermique.
- Si une réaction chimique a un changement d'enthalpie inférieur à zéro (ΔH < 0) est exothermique.
Suivre avec:
- Phénomènes physicochimiques
- La chimie au quotidien
- La chimie au quotidien
- Chimie organique et inorganique
Les références
- Soto-Córdoba, S. (2016). Réactions endothermiques. Référentiel technologique Institut technologique du Costa Rica.
- Corominas, J. (2017). Réactions chimiques de la vie quotidienne. Alambic, (90), 8-26.
- Sánchez, M. T. M., & Sánchez, M. M. (2002). Etude expérimentale des réactions endothermiques pour les étudiants de l'ESO. Annales de chimie du RSEQ, (4), 36-39.
