Exemple d'analyse volumétrique
Chimie / / July 04, 2021
Au Chimie analytique, la Volumétrie est une méthode d'analyse qui consiste à Mesure du volume de réactif nécessaire pour réagir stœchiométriquement avec l'analyte, qui est la substance à déterminer.
Réagir stœchiométriquement fait référence aux substances interagissant chimiquement, selon le proportion qui marque l'équation chimique déjà équilibré.
La substance à étudier est appelée Analyte. A partir de cette substance, un volume connu et exactement mesuré sera prélevé comme échantillon, que nous appellerons Aliquote, contenu dans un erlenmeyer pour commencer l'analyse.
Concepts de l'analyse volumétrique
L'analyse volumétrique, étant un type de Analyse chimique, porter impliquait une réaction chimique. Cette réaction chimique sera réalisée entre l'échantillon avec une quantité inconnue de la substance étudiée, et une quantité connue d'une autre substance, capable de réagir avec la première.
le Les substances de réaction seront en solution aqueuse, et les volumes de solutions qui ont interagi pour atteindre la fin de la réaction seront mesurés, ce qui sera visible grâce à un indicateur qui donnera une couleur à l'intérieur du flacon.
En analyse volumétrique, la solution aqueuse de La concentration connue est appelée solution standard, Standard ou titrant, et servira de référence pour, en terminant la réaction, faire le calcul qui révélera la quantité de la substance étudiée.
Cette procédure consistant à faire réagir les deux solutions est appelée Diplôme Chimique o Évaluation, qui est la partie fondamentale de l'analyse volumétrique. consiste à aller verser progressivement la Solution Standard (Titrant) dans l'aliquote (Échantillon), jusqu'à ce que l'indicateur indique le changement avec une différence de couleur.
UNE Indicateur C'est une substance chimique qui est ajoutée à l'aliquote, montrant une coloration, et qui lorsque la réaction se termine, elle changera de couleur.
Une analyse volumétrique consiste en une simple série d'étapes :
1.- Préparation de la solution standard
2.- Préparation de l'échantillon ou de l'aliquote
3.- Diplôme Chimique
4.- Mesure de volume
5.- Calcul de la substance étudiée.
Au point où ils ont déjà pleinement réagi les deux substances, on l'appelle Point d'équivalence.
Comme dans toute méthode d'analyse chimique, l'analyse volumétrique nécessite de bons résultats :
-La réaction chimique doit être SélectifC'est-à-dire que la solution étalon ne réagira qu'avec l'échantillon.
-La réaction chimique doit être Stoechiométrique, c'est-à-dire obéir aux proportions marquées dans l'équation chimique équilibrée.
-La réaction chimique doit être Quantitatif; fait référence à un achèvement de 99,9 % au point d'équivalence.
-Il doit y avoir un point final détectable en réaction, ce qui sera mieux confirmé par l'indicateur.
Motif principal
Les Motifs primaires Ce sont des substances d'une grande pureté dont la concentration en solution est calculée directement à partir de la quantité pesée et du volume d'eau utilisé.
A) Oui, peut être réagi avec des solutions de travail, pour connaître les concentrations de ces dernières et les convertir en solutions étalons.
Voici des exemples de modèles principaux :
-Carbonate de sodium (Na2CO3): Utilisé pour normaliser les acides, tels que l'acide sulfurique.
-Biphtalate de potassium: c'est l'étalon principal pour préparer des solutions étalons de bases, telles que l'hydroxyde de sodium.
-Chlorure de sodium (NaCl): Il est utilisé pour standardiser les solutions de nitrate d'argent.
-Carbonate de calcium (CaCO3): Standard primaire pour l'EDTA (Ethylène Diamine Tétraacétique Acide).
Un Pattern Primaire doit répondre à plusieurs caractéristiques essentielles :
Doit avoir un Haute pureté, Stabilité atmosphérique, Absence d'eau d'hydratation, Faible coût et facile à obtenir, Oui Poids équivalent élevé.
Classification de l'analyse volumétrique
Selon les espèces chimiques avec lesquelles vous travaillez pour faire une analyse, ce sera le type de Volumétrie :
Volumétrie acido-basique : Il fonctionne, soit avec un acide, soit avec une base, pour analyser des échantillons contenant des acides ou des bases.
Volumétrie des précipitations : Également appelée argentométrie, elle utilise une solution standard de nitrate d'argent pour déterminer le nombre de chlorures contenus dans un échantillon.
Complexité Volumétrie : Une solution standard d'un agent complexant, tel que l'EDTA, est utilisée pour mesurer la concentration de dureté, c'est-à-dire les carbonates de calcium et de magnésium, dans l'eau.
Volumétrie REDOX : La réaction se produit entre une substance oxydante et une substance réductrice.
Indicateurs
Parmi les nombreux indicateurs utilisés en Volumétrie, trois se distinguent :
1.- Orange de méthyle : Il prend une coloration orange dans l'aliquote, qui sera titré avec un acide. Lorsque le point d'équivalence est atteint, l'indicateur devient jaune.
2.- Phénophtaléine : Il est transparent au départ dans l'aliquote, qui sera titré avec une base. Lorsque le point d'équivalence est atteint, l'indicateur devient rose.
3.- Noir Ériochrome : C'est l'indicateur utilisé pour déterminer la dureté de l'eau. Au début, il est violet dans l'aliquote, jusqu'à ce qu'il soit titré avec un agent complexant. A la fin de la réaction, il devient bleu.

Instruments dans une analyse volumétrique
Dans une analyse volumétrique, une série d'instruments seront utilisés qui, s'ils ne sont pas disponibles, ne peuvent pas être développés de manière adéquate :
1.- Fiole jaugée: C'est un récipient en forme de bulbe dans sa partie inférieure, aplatie au fond, qui comporte une fine colonne dans laquelle le liquide est ajouté. Il a une marque pour indiquer où doit être le ménisque du liquide, de sorte qu'il couvre le volume exact. Il est utilisé pour contenir des solutions standard; grâce à la précision de son volume, une concentration connue est assurée.

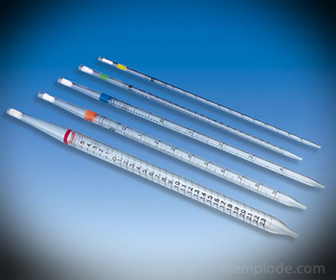
2.- Pipettes: Ce sont des tubes minces gradués qui permettent de mesurer de manière fiable des quantités exactes de liquide. Ils sont disponibles jusqu'à 25 millilitres et permettent un échantillonnage précis.
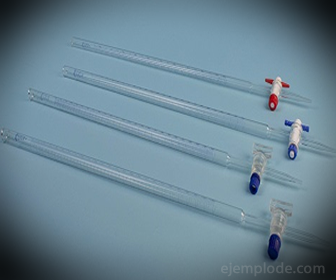
3.- Burette: C'est un tube allongé d'une capacité de 50 millilitres, qui contiendra la Solution Standard. À l'une de ses extrémités, il a une vanne de régulation de débit qui drainera la solution dans l'aliquote.
4.- Fioles Erlenmeyer: Ce sont des récipients à fond plat, de forme conique qui se termine par un bord cylindrique. Cette conception les rend adaptés aux titrages chimiques, car ils ne permettent pas à l'agitation des solutions de les déborder. Un minimum de trois sera requis si des tests répétitifs doivent être effectués, afin d'assurer un résultat fiable.

Calculs dans une analyse volumétrique
Lorsque des solutions aqueuses sont manipulées, les quantités importantes pour une analyse volumétrique sont la concentration et le volume.
L'équation principale de la volumétrie est basée sur quatre données principales :
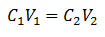
C1= Concentration de l'échantillon (inconnue)
V1= Volume de l'Aliquot, avec lequel l'analyse a été travaillée
C2= Concentration de la solution étalon utilisée pour atteindre le point d'équivalence
V2= Volume de solution standard nécessaire pour atteindre la fin de la réaction
Les données sont substituées dans l'équation, ne laissant que la concentration recherchée comme inconnue. Bien sûr, toutes les données doivent être sur les mêmes disques.
Exemples d'analyse volumétrique
Détermination des chlorures (Cl-) par argentométrie, au nitrate d'argent.
Détermination des Bromures (Br-) par Argentométrie, au Nitrate d'Argent.
Détermination des Cyanures (CN-) par Argentométrie, au Nitrate d'Argent.
Détermination du carbonate de magnésium (MgCO3), par complexométrie, avec EDTA.
Détermination du carbonate de calcium (CaCO3), par complexométrie, avec EDTA.
Analyse de l'acide sulfurique (H2SW4) avec de l'hydroxyde de sodium (NaOH).
Analyse de l'hydroxyde de sodium (NaOH) avec l'acide chlorhydrique (HCl).
Détermination de l'antimoine (III) avec du permanganate de potassium (KMnO4).
Détermination de l'arsenic (III) avec le permanganate de potassium (KMnO4).
Détermination du Titane (III) avec du Permanganate de Potassium (KMnO4).
Détermination du molybdène (III) avec du permanganate de potassium (KMnO4).
Détermination du fer (II) avec du permanganate de potassium (KMnO4).
Détermination de l'ion oxalate avec du permanganate de potassium (KMnO4).