Exemple d'éléments chimiques
Chimie / / July 04, 2021
Un élément chimique c'est une substance pure composée d'atomes du même type, à son tour formé par un certain nombre de protons et de neutrons dans le noyau, et une quantité de électrons dans leurs orbitales. Certains se trouvent naturellement, d'autres en formant les molécules d'un composé, et d'autres ont été créés par l'exécution de procédures de laboratoire. Tous les éléments chimiques constituent la matière de l'univers entier et soutiennent l'existence et le fonctionnement du corps humain.
Chaque élément a des caractéristiques et des comportements qui lui confèrent une distinction et le rendent unique, mais en même temps il présente des similitudes avec un groupe d'éléments dans la manifestation qu'ils ont dans le univers. Pour cette raison, il existe le tableau périodique des éléments chimiques, qui traite de ces similitudes pour regrouper les éléments de manière cohérente et faciliter l'étude de leurs propriétés.
Numéro atomique d'un élément
L'atome porte dans le noyau un certain nombre de protons, accompagnés du même nombre de neutrons
. A ce numéro ça s'appelle le numéro atomique, représenté par Z à des fins académiques et en littérature. Pour chaque élément, ce numéro sera unique. Il n'y a pas deux éléments avec le même numéro atomique. Le tableau périodique se concentre également sur ce critère pour les classer.Symbole d'un élément
A l'époque de l'Alchimie, qui s'étend sur environ l'année 400 à 1000 après JC. C., les alchimistes ont enregistré leurs expériences en attribuant des symboles aux éléments. C'étaient des symboles simples, réalisés avec des figures géométriques, pour représenter l'élément individuel et les transformations étudiées.
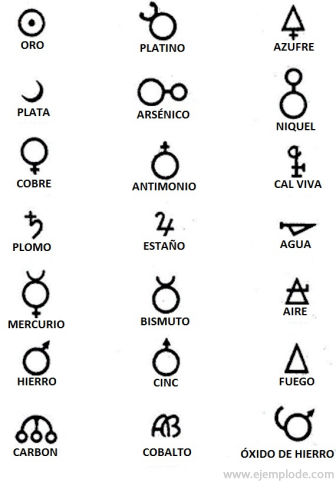
Quelques exemples de symboles alchimiques, avec le nom de l'élément ou du composé qu'ils représentaient.
À l'ère de la chimie moderne, les éléments sont encore représentés par des symboles, dans ce cas des lettres qui font référence à leur nom en latin ou en anglais.
Par exemple:
Le symbole du sodium est N / A, de son nom latin Natrium
Le symbole de l'or est Au, de son nom latin Aurum
Le symbole de l'argent est Ag, de son nom latin Argentum
Le symbole du cuivre est Cu, de son nom latin Cuprum
Le symbole de l'antimoine est Sb, de son nom latin Stibium
Le symbole du fer est Foi, de son nom latin Ferrum
Le symbole de Mercure est Hg, de son nom latin Hydrargyrum, ce qui signifie "argent liquide"
Le symbole du potassium est K, de son nom latin Kalium
Groupes d'éléments chimiques :
Le tableau périodique des éléments chimiques les classe par groupes: groupes A et groupes B. Les groupes A sont huit, qui contiennent les éléments Alcalin, Les alcalino-terreux, Les Terreos, trois familles d'Eléments, dont la tête définit le nom de la famille: Famille Carbone, Famille de l'azote, Famille du soufre, Les Halogènes et les gaz nobles. Les groupes B sont constitués de tous les Métaux de transition et les Terres Rares, qui sont aussi deux grandes Familles: Lanthanides Oui Actinides.
Groupe IA: Éléments alcalins:
La série des éléments alcalins est constituée de l'hydrogène (H), du lithium (Li), du sodium (Na), du potassium (K), du rubidium (Rb), du césium (Cs) et du francium (Fr). Ils ont tous une configuration électronique telle que dans la dernière couche ils ont un électron. Son nom est dû au fait qu'au contact de l'eau, ils réagissent en formant des alcalis ou des hydroxydes. C'est un comportement général entre ces éléments. Plus l'atome de l'élément est gros, plus il est réactif, car la force avec laquelle le noyau retient l'électron de la dernière couche a de moins en moins de portée. Ils sont capables de former des liaisons ioniques avec des halogènes. Par exemple: La liaison ionique qui a une présence abondante, est celle de Sodium-Chlore, formant du Chlorure de Sodium NaCl.
Groupe IIA: Éléments alcalino-terreux:
Ces éléments sont: le Béryllium (Be), le Magnésium (Mg), le Calcium (Ca), le Strontium (Sr), le Baryum (Ba) et le Radium (Ra). Ils ne sont pas de nature libre; par contre, ses carbonates et silicates existent en relative abondance. Ils sont blancs argentins et cristallins. Ils se combinent facilement avec l'oxygène s'ils sont exposés à l'air. Cela est dû, en partie, au fait qu'ils ont deux électrons dans leur dernière couche, en accord avec la capacité de réception d'oxygène. Le baryum est l'élément le plus actif du groupe et, avec le calcium, ils ont les applications les plus industrielles du groupe.
Groupe IIIA: Éléments de la Terre:
Le groupe IIIA comprend les éléments Bore (B), Aluminium (Al), Gallium (Ga), Indium (In) et Thallium (Tl). Le bore est un élément non métallique, l'aluminium est amphotère (amphiprotique), c'est-à-dire qu'il est capable d'agir comme un acide et comme une base; et les trois autres sont des éléments métalliques. Ils ont trois électrons dans leur dernière couche, générant une valence de +3, bien que parfois le gallium agisse avec une valence +1 et +2 dans certains de ses composés. Le bore est le seul élément de cette série qui forme des hydrures. Le bore et l'aluminium forment des carbures.
Groupe IVA: Carbone Famille:
Les éléments représentatifs du groupe IVA sont le carbone (C), le silicium (Si), le germanium (Ge), l'étain (Sn) et le plomb (Pb). Les deux premiers sont fondamentalement non métalliques dans leurs caractéristiques, mais le germanium, l'étain et le plomb sont métalliques, d'autant plus que leur numéro atomique est élevé. A l'exception du silicium, chaque élément a les valences +4 et +2.
Le carbone et le silicium forment des composés dans lesquels les atomes des éléments sont reliés par des paires d'électrons partagés. Le carbone est l'essence des composés organiques en s'associant à des atomes d'hydrogène, d'oxygène, d'azote, de soufre et parfois de silicium.
Le silicium et le germanium sont utilisés pour la fabrication de composants électroniques, car ils ont la propriété de se comporter comme des semi-conducteurs.
Groupe VA: Azote Famille :
Le groupe VA comprend les éléments Azote (N), Phosphore (P), Arsenic (As), Antimoine (Sb) et Bismuth (Bi). L'azote et le phosphore sont non métalliques, l'arsenic et l'antimoine sont des métalloïdes et le bismuth est un métal. Ces éléments se caractérisent par la formation d'Hydrures, dont le moins toxique est l'Ammoniac NH3. L'azote forme l'acide nitrique HNO3, impliqué avec l'acide chlorhydrique dans Agua Regia, un mélange capable de dissoudre les métaux précieux tels que l'or et l'argent.
L'azote est également impliqué dans deux grands groupes de composés organiques appelés amines et amides, qui peuvent être considérés comme des dérivés de l'ammoniac NH3, par substitution d'un Hydrogène par une chaîne Hydrocarbure.
Groupe VIA: Oxygène Famille:
Composé des éléments Oxygène (O), Soufre (S), Sélénium (Se), Tellure (Te) et Polonium (Po). L'oxygène est le plus actif et a la capacité de former facilement des liaisons covalentes. Au contact des métaux dans un environnement très humide, il forme des oxydes. Il forme une molécule résonante appelée Ozone, qui protège la planète des rayons UV.
Groupe VIIA: Halogènes:
Son nom signifie « Formateurs de vente ». Le groupe est composé des éléments Fluor (F), Chlore (Cl), Brome (Br), Iode (I) et Astate (At). Ils ont sept électrons dans la dernière couche, ce qui leur permet d'être les récepteurs d'un électron. Cette qualité les fait se lier avec les éléments du groupe IA, formant des sels binaires. Le fluor se caractérise par la plus grande électronégativité de tout le tableau périodique, avec une valeur de 4,0, son homologue étant le césium, avec une électronégativité de 0,7. Cette propriété lui permet d'avoir la force d'attirer d'autres atomes et de privilégier la formation d'une liaison avec elles ou ils.
Groupe VIIIA: Gaz nobles:
Aussi appelé Groupe des gaz inertes, il est composé des éléments Hélium (He), Néon (Ne), Argon (Ar), Krypton (Kr), Xénon (Xe) et Radon (Ra). Ce sont les éléments qui ont toute leur configuration électronique complète, ils ne sont donc pas capables de réagir dans les conditions habituelles. Ils sont principalement utilisés pour les enseignes commerciales lumineuses, émettant de la lumière visible lorsqu'un courant électrique les atteint.
Groupes B: Métaux de transition:
En dix groupes de trois éléments chacun, les métaux de transition sont regroupés. Ceux-ci incluent les meilleurs conducteurs électriques: Argent (Ag), Cuivre (Cu), Or (Au); les meilleurs composants structurels pour la construction et l'ingénierie urbaines; Fer (Fe), Titane (Ti), Aluminium (Al), Zirconium (Zr), Tungstène (W); les meilleurs composants catalytiques: Nickel (Ni), Vanadium (V), Platine (Pt); et les principaux ingrédients du revêtement: Cadmium (Cd), Chrome (Cr), Zinc (Zn). Ils gèrent généralement les valences entre +1 et +3, mais des éléments comme Chromium gèrent les valences +2, +3, +6.
Terres Rares: Lanthanides et Actinides:
On les appelle Terres Rares en raison de leur rareté sur la planète. Ils sont constitués de deux groupes: les lanthanides et les actinides. Ils se trouvent sur les deux lignes distinctes du tableau périodique. Ils fonctionnent généralement avec une valence de +3 et ont tendance à former des hydroxydes. L'élément le plus important d'entre eux est le cérium, qui est utilisé dans la préparation d'alliages pyrophoriques (alliage Mischmétal, pour pierres pour briquets), dans les tuyaux de gaz pour l'éclairage et dans la fabrication de verres spéciaux absorbant les rayons ultraviolets et le rayonnement thermique.
Les éléments radioactifs les plus puissants, comme l'Uranium (U) et le Plutonium (Pu), font partie de ces groupes. qui, compte tenu de leur instabilité, libèrent de l'énergie et se désintègrent, perdant des particules Alpha (noyaux de Hélium). Plus tard, ils deviennent des éléments moins instables, selon la série radioactive.