Qu'est-ce que l'électrolyse
Chimie / / July 04, 2021
En chimie, Électrolyse est le phénomène dans lequel un courant électrique traverse une solution aqueuse d'un composé ionique, et commence diriger les ions (particules chargées) du composé a deux électrodes, positif (Anode, attire les anions chargés négativement) et négative (Cathode, attire les cations chargés positivement). Ce phénomène est régi par la loi de l'électrostatique, qui indique que des charges opposées s'attirent.
Électrolytes
En 1883, Michael Faraday découvert que les solutions aqueuses de certaines substances conduisent le courant électrique, alors que les solutions d'autres substances ne le font pas.
Pour tester si une solution aqueuse conduit ou non le courant électrique, Faraday a conçu un appareil simple composé d'un Circuit 110 volts CC, une lampe, Oui deux électrodes en métal ou en graphite connectées à la source actuelle.
Si les électrodes sont immergées dans l'eau, la quantité de courant circulant est si faible que la lampe ne s'allume pas; il en est de même s'ils sont trempés dans une solution sucrée.
Au contraire, s'ils sont plongés dans une solution de Chlorure de sodium NaCl ou de Acide chlorhydrique HCl, la lampe brille de mille feux, ce qui prouve que le la dissolution est un excellent conducteur. D'autre part, en utilisant l'acide acétique CH3COOH concentré, la solution conduit mal le courant, mais lorsque l'acide est dilué avec de l'eau H2Ou, sa conductivité électrique augmente.
Lors du passage du courant à travers différentes solutions, différents produits sont obtenus au niveau des électrodes.
Au cours de ses études sur l'électrolyse, Faraday a déduit les lois suivantes :
1ère loi : La quantité de substance qui subit sa transformation chimique dans une électrode est proportionnelle à la quantité d'électricité qui traverse la solution.
2e loi : Si la même quantité d'électricité est passée à travers différentes solutions, le poids des substances décomposés ou déposés sur les différentes électrodes sont proportionnels aux poids équivalents desdits substances.
Pour citer un exemple :
On supposera que vous disposez de cinq cellules électrolytiques différentes. Le premier avec Acide chlorhydrique HCl, la seconde avec Sulfate de cuivre CuSO4, le troisième avec Chlorure d'antimoine SbCl3, le quatrième avec Chlorure stanneux SnCl2 et le cinquième avec Chlorure Stannique SnCl4.
Le même courant traverse une série de cellules électrolytiques, jusqu'à ce que 1 008 grammes d'hydrogène aient été libérés (un Poids équivalent d'hydrogène) de la solution d'acide chlorhydrique, les poids (en grammes) des autres produits libérés dans le même temps ils sont:
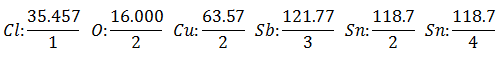
le Poids équivalent a la valeur de Poids atomique de l'élément divisé par la valence de l'élément.
Pour libérer un poids équivalent de n'importe quel article, vous devez 96500 Coulombs. Cette quantité d'électricité est appelée 1 Faraday.
L'unité Faraday
L'ampère est défini comme un flux uniforme qui dépose 0,001118 grammes d'argent (Ag) à partir d'une solution de nitrate d'argent (AgNO3) dans une seconde. Puisque le poids atomique de l'argent est de 107,88 g / mol, le rapport 107,88 / 0,001118 donne le nombre d'Ampère-secondes ou Coulombs électricité nécessaire déposer un équivalent chimique de l'argent. Cette quantité est de 96494 Coulombs (la valeur de 96500 est assez approximative pour des calculs plus simples), et est appelée 1 Faraday d'électricité.
Électrodes
Faraday a appelé Anode à électrode positive et cathode à électrode négative. Il a également créé les termes Anion et Cation, appliqués aux substances qui apparaissent respectivement à l'anode et à la cathode lors de l'électrolyse.
Actuellement, une autre définition des électrodes est :
Anode: Électrode dans laquelle il y a perte d'électrons ou oxydation.
Cathode: Électrode dans laquelle il y a gain ou réduction d'électrons.
Électrolytes et non-électrolytes
La conduction du courant électrique à travers les solutions n'a été expliquée de manière satisfaisante qu'en 1887, lorsque Svante Arrhenius a fait connaître sa théorie. Avant d'apprécier et de comprendre la théorie d'Arrhenius, nous avons d'abord exposé certains des faits connus de la science lorsqu'Arrhenius l'a formulée :
le Solutions non électrolytiques ils ont des propriétés qui peuvent être calculées en appliquant la loi de Raoult. Les pressions de vapeur et les points d'ébullition et de congélation observés de ces solutions sont pratiquement les mêmes que les valeurs calculées.
La La loi de Raoult explique que la pression de vapeur de chaque soluté en solution dépend de sa propre fraction molaire, multipliée par sa pression de vapeur à l'état pur.

La loi de Raoult échoue lorsqu'elle est appliquée aux solutions électrolytiques dans l'eau. Les variations de la pression de vapeur et des points d'ébullition et de congélation sont toujours supérieures à celles prévues par la loi précitée et, de plus, elles augmentent lors de la dilution.
De tels écarts sont représentés par la valeur i, qui est le rapport de la variation observée du point de congélation entre la variation calculée du point de congélation :

La valeur de i est une mesure de l'écart par rapport à la loi de Raoult, étant égale à 1 lorsqu'il n'y a pas d'écart.
Conductivité électrique des électrolytes
Arrhenius a étudié la conductivité de solutions électrolytiques aqueuses pour découvrir comment la conductivité variait avec la concentration d'électrolyte.
Il a mesuré la conductivité molaire (qui est la conductivité correspondant à une mole d'électrolyte dissous; c'est-à-dire que la conductivité spécifique se réfère à une mole, et a constaté qu'elle augmentait avec la dilution.
Arrhenius a comparé ses résultats avec les mesures des écarts par rapport à la loi de Raoult et a trouvé une relation étroite entre ceux-ci et la conductivité molaire. Dans sa théorie, le comportement des électrolytes est expliqué :
« Les molécules d'électrolyte se dissocient en particules chargées électriquement appelées ions. La dissolution est incomplète et il existe un équilibre entre les molécules et leurs ions. Les ions conduisent le courant lorsqu'ils se déplacent dans la solution ».
Les écarts par rapport à la loi de Raoult sont dus à l'augmentation du nombre de particules résultant de la dissociation partielle des molécules.
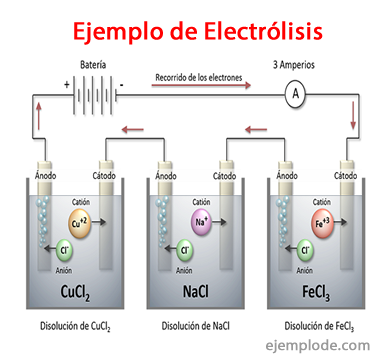
Exemples d'électrolyse
Certaines solutions qui se comportent comme des électrolytes, c'est-à-dire qu'elles ont la capacité d'électrolyse sont :
Chlorure de sodium NaCl
Acide chlorhydrique HCl
Sulfate de sodium Na2SW4
Acide sulfurique H2SW4
Hydroxyde de sodium NaOH
Hydroxyde d'ammonium NH4Oh
Carbonate de sodium Na2CO3
Bicarbonate de sodium NaHCO3
Acide nitrique HNO3
Nitrate d'Argent AgNO3
Sulfate de zinc ZnSO4
