Exemple de composés aromatiques
Chimie / / July 04, 2021
Les chimistes ont trouvé utile de diviser tous les composés organiques en deux grandes classes: les composés Aliphatique et composés Aromatiques. Les composés aromatiques sont le benzène et les composés ayant un comportement chimique similaire. Les propriétés aromatiques sont ce qui distingue le benzène des hydrocarbures aliphatiques. La molécule de benzène est un anneau d'un type particulier. Il existe d'autres composés, également en forme d'anneau, qui semblent différer structurellement du benzène et pourtant se comportent de manière similaire.
Il s'avère que ces autres composés ressemblent au benzène dans leur structure électronique de base, c'est pourquoi ils se comportent également comme des aromatiques.
Les hydrocarbures aliphatiques (alcanes, alcènes, alcynes et leurs analogues cycliques) réagissent principalement par une addition, en plusieurs liens, et par substitution radicalaire, à d'autres points de la chaîne aliphatique.
En revanche, les hydrocarbures aromatiques, on souligne qu'ils ont tendance à
substitution hétérolytique. De plus, ces mêmes réactions de substitution sont caractéristiques des cycles aromatiques partout où ils apparaissent, quels que soient les autres groupes fonctionnels que la molécule pourrait contenir. Ces derniers groupes affectent la réactivité des cycles aromatiques, et vice versa.La molécule de benzène
Le benzène est connu depuis 1825 et ses propriétés chimiques et physiques sont mieux connues que celles de tout autre composé organique. Malgré cela, ce n'est qu'en 1931 qu'une structure satisfaisante a été proposée pour cette substance, et il a fallu jusqu'à 15 ans pour qu'elle soit d'usage général parmi les produits chimiques biologique. La difficulté résidait dans les limites du développement auquel la théorie structurale avait alors atteint. La structure finale a été atteinte grâce à l'hypothèse de plusieurs faits importants :
Le benzène a la formule moléculaire C6H6. En raison de sa composition élémentaire et de son poids moléculaire, le benzène était connu pour avoir six atomes de carbone et six atomes d'hydrogène. Le problème était de connaître l'arrangement de tels atomes.
En 1858, August Kekulé a proposé que les atomes de carbone puissent être liés entre eux pour former des chaînes. Plus tard, en 1865, il propose une réponse au problème du benzène: ces chaînes carbonatées peuvent parfois se fermer, pour former des anneaux.
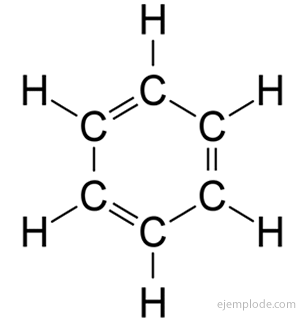
Le benzène ne donne qu'un produit monosubstitué C6H5Oui. Par exemple, lorsqu'un atome d'hydrogène est remplacé par du Brome, une seule configuration de BromoBenzène C est obtenue.6H5Frère; de manière analogue, un ChloroBenzène C est également obtenu6H5Cl, ou un NitroBenzène C6H5NE PAS2, etc. Ce fait impose une limitation sévère à la structure du Benzène: tout son Hydrogène doit être exactement équivalents, c'est-à-dire qu'ils doivent tous être joints à des carbones qui à leur tour sont tous également lié. Il ne peut y avoir d'hydrogène dans CH3, et d'autres en CH2, et d'autres en CH. La structure finale du monosubstitué doit être la même pour la substitution de tout hydrogène dans le benzène.
Le benzène donne trois produits disubstitués isomères, C6H4Oui2 ou C6H4ET Z. Il n'y a que trois dibromobenzènes isomères, C6H4Br2, trois ChloroNitroBenzènes C6H4ClNO2, etc. Ce fait limite encore les possibilités structurelles.
Le benzène subit des réactions de substitution plutôt que des réactions d'addition. La structure benzénique de Kekulé correspond à celle que nous appellerions Cyclohexatriène. De ce fait, il devrait réagir facilement par addition, comme le font les composés similaires, le cyclohexadiène et le cyclohexène, ce qui est une caractéristique de la structure alcène. Mais ce n'est pas le cas; dans des conditions où les alcènes réagissent rapidement, le benzène ne réagit pas, ou seulement très lentement. Au lieu de réactions d'addition, le benzène subit facilement un ensemble de réactions, qui sont toutes substitution, comme la Nitration, la Sulfonation, la Halogénation, la Alkylation de Friedel-Crafts, la Acylation de Friedel-Artisanat. Dans chacune de ces réactions, un atome ou un groupe a été remplacé par l'un des atomes d'hydrogène du benzène.
La stabilité du benzène est due aux doubles liaisons alternées et aussi à l'énergie de résonance, en celui dans lequel les doubles liaisons changent de position entre les carbones, en maintenant la même alternance de construction. Est énergie de stabilisation de résonance est responsable de l'ensemble des propriétés appelées Propriétés aromatiques.
Une réaction d'addition transforme un alcène en un composé saturé plus stable. Mais dans le cas du Benzène, un Addition le rend moins stable en détruisant le système annulaire soutenu et stabilisé par résonance. La molécule finale serait le cyclohexadiène. C'est à cause de ce fait que la stabilité du Benzène ne le conduit qu'à des réactions de Substitution.
Propriétés des composés aromatiques
En plus des substances qui contiennent des cycles benzéniques, il en existe de nombreuses autres qui sont considérées comme aromatiques, bien qu'en surface elles ne ressemblent guère au benzène.
D'un point de vue expérimental, les composés aromatiques sont des substances dont les formules moléculaires suggèrent une haut degré d'insaturation, malgré quoi ils sont résistant aux réactions d'addition si caractéristique des composés insaturés.
Au lieu de cela, ces composés aromatiques un subissent souvent des réactions de substitution électrophile similaires à ceux du benzène. A côté de cette résistance à l'addition, et probablement à cause d'elle, il existe des preuves d'une stabilité inhabituelle, telles que les faibles chaleurs d'hydrogénation et de combustion.
Les substances aromatiques sont cycliques, présentant généralement des anneaux de cinq, six et sept atomes, et leur examen physique montre qu'ils ont molécules plates ou presque plates. Ses protons ont le même type de déplacement chimique dans les spectres de résonance magnétique nucléaire que dans le benzène et ses dérivés.
D'un point de vue théorique, pour qu'une substance soit aromatique, sa molécule doit avoir des nuages cycliques d'électrons π délocalisés au-dessus et au-dessous du plan de la molécule; de plus, ces nuages π doivent contenir au total (4n + 2) électrons; cela signifie qu'une délocalisation n'est pas suffisante pour qu'il en résulte la stabilité particulière qui caractérise un composé aromatique.
Nomenclature des dérivés du benzène (composés aromatiques)
Dans le cas de beaucoup de ces dérivés, en particulier dans les monosubstitués, il suffit de précéder le nom du groupe substituant du mot Benzène, tel que, par exemple, ChloroBenzene, BromoBenzene, IodoBenzene, Nitrobenzène.
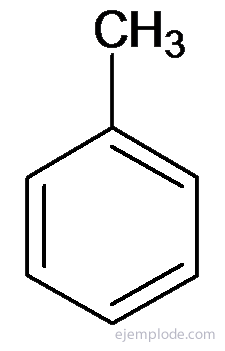
D'autres dérivés ont des noms spéciaux qui peuvent manquer de similitude avec le nom du groupe substituant. Par exemple, le méthylbenzène n'est connu que sous le nom de toluène; l'aminobenzène sous forme d'aniline; Hydroxybenzène comme phénol, etc.
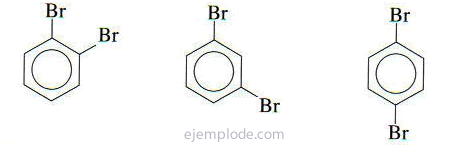
S'il y a deux groupes attachés au cycle benzénique, il est non seulement nécessaire d'identifier lesquels ils sont, mais aussi d'indiquer leur emplacement relatif. Les trois isomères possibles pour les benzènes disubstitués sont caractérisés par les préfixes ortho, meta et para, abrégés o-, m-, p-. Par exemple: o-DiBromoBenzene, m-DiBromoBenzene, p-DiBromoBenzene.
Si l'un des deux groupes est du type qui donne à la molécule un nom spécial, le composé est nommé comme un dérivé de cette substance spéciale. Par exemple: NitroToluène, Bromophénol, etc.
Exemples de composés aromatiques
Toluène ou Méthylbenzène
Éthylbenzène
Isopropylbenzène
TriNitroToluène ou TNT
Aniline ou aminobenzène
Acide benzoique
Acide glutamique ou acide paraaminobenzoïque
Acide toluène sulfonique
Phénol ou hydroxybenzène
Bromophénol
Trichlorobenzène
Benzène Phényl Ether
Iode benzène
Bromo benzène

