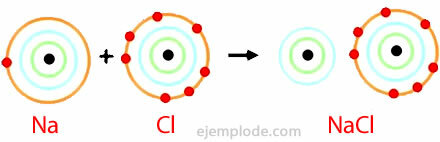
Exemple de liaison ionique
Chimie / / July 04, 2021
La liaison ionique est donnée par la présence d'un cation et d'un anion, espèces chimiques avec des charges électriques de signes opposés. Elle est définie comme la force électrostatique qui lie les ions dans un composé ionique.
Les atomes d'éléments à faible énergie d'ionisation ont tendance à former des cations. En revanche, ceux qui ont une affinité électronique élevée ont tendance à former des anions.
Les métaux alcalins et alcalino-terreux sont plus susceptibles de former des cations dans les composés ioniques, et les halogènes et l'oxygène sont les plus susceptibles de former des anions. En conséquence, la composition d'une grande variété de composés ioniques résulte de l'association d'un métal du groupe IA ou IIA et d'un halogène ou d'un oxygène.
Par exemple, la réaction entre le lithium et le fluor produit du fluorure de lithium, une poudre blanche toxique utilisée pour abaisser le point de fusion de la soudure et dans la fabrication de céramiques. La configuration électronique du lithium est 1s
2, 2s1, et celui du Fluor est de 1s2, 2s2, 2P5. Lorsque ces atomes entrent en contact, l'électron de valence 2s1 Le lithium est transféré à l'atome de fluor.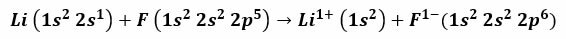
Il est valable de supposer que la procédure commence par le détachement de l'électron de lithium, en l'ionisant pour atteindre la valence positive 1+. Elle se poursuit par la réception de cet électron par le Fluor, ce qui lui confère une charge négative. Au final, la formation de la liaison ionique se produit par attraction électrostatique. Le composé de fluorure de lithium sera électriquement neutre.
De nombreuses réactions courantes conduisent à la formation de liaisons ioniques. Par exemple, la combustion du calcium dans l'oxygène produit de l'oxyde de calcium :
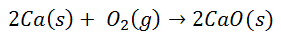
La molécule d'oxygène diatomique se sépare en deux atomes individuels. Ensuite, il y aura un transfert de deux électrons de l'atome de calcium vers chaque atome d'oxygène. Les deux auront alors leurs charges respectives: pour le Calcium 2+ pour chaque atome, et pour l'Oxygène 2- pour chaque atome. Lors de la liaison finale, la molécule d'oxyde de calcium est électriquement neutre.
Énergie de réseau des composés ioniques
Avec l'énergie d'ionisation et les valeurs d'affinité électronique des éléments, il est possible de prédire ce que éléments forment des composés ioniques, mais il est également nécessaire d'évaluer la stabilité de ce type de composés.
L'énergie d'ionisation et l'affinité électronique sont définies pour les processus qui se produisent en phase gazeuse, bien que tous les composés ioniques soient solides à 1 atmosphère de pression et à 25 ° C. L'état solide est une condition très différente car chaque cation est entouré d'un nombre spécifique d'anions et vice versa. Par conséquent, la stabilité globale du composé ionique solide dépend des interactions de tous les ions et pas seulement de l'interaction d'un cation avec un anion.
Une mesure quantitative de la stabilité de tout solide ionique est sa énergie réticulaire, qui est défini comme L'énergie nécessaire pour séparer complètement une mole d'un composé ionique solide en ses ions à l'état gazeux.
Cycle de Born-Haber pour déterminer l'énergie du réseau
Il n'est pas possible de mesurer directement l'énergie du réseau. Cependant, si la structure et la composition d'un composé ionique sont connues, il est possible de calculer son énergie de réseau en appliquant la loi de Coulomb, qui déclare que l'énergie potentielle entre deux ions est directement proportionnelle au produit de leurs charges et inversement proportionnelle à la distance qui les sépare. Arrêter.
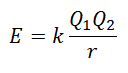
Puisque la charge du Cation est positive et celle de l'Anion est Négative, le produit donnera un résultat négatif en Énergie. Cela représente une réaction exothermique. Par conséquent, pour inverser le processus, de l'énergie doit être fournie.
Il est également possible de déterminer indirectement l'énergie du réseau si l'on suppose qu'un composé ionique se forme en plusieurs étapes. Cette procédure est connue sous le nom Cycle de Born-Haber, qui relie les énergies de réseau des composés ioniques avec les énergies d'ionisation, l'affinité électronique et d'autres propriétés atomiques et moléculaires. Cette méthode est basée sur la loi de Hess de la somme algébrique des réactions chimiques et a été développée par Max Born et Fritz Haber. Le cycle de Born-Haber définit les différentes étapes qui précèdent la formation d'un solide ionique.

Chlorure de sodium
Le chlorure de sodium est un composé ionique ayant un point de fusion de 801°C, qui conduit l'électricité à l'état fondu et en solution aqueuse. Le sel gemme est l'une des sources de chlorure de sodium et il se trouve dans des gisements souterrains qui ont généralement plusieurs centaines de mètres d'épaisseur. Le chlorure de sodium est également obtenu à partir d'eau de mer ou de saumure (une solution concentrée de NaCl) par évaporation solaire. En outre, il se trouve dans la nature dans le minéral appelé Halite.

Le chlorure de sodium est utilisé plus que tout autre matériau dans la fabrication de composés chimiques inorganiques. La consommation mondiale de cette substance est d'environ 150 millions de tonnes par an. Le chlorure de sodium est principalement utilisé dans la production d'autres composés chimiques inorganiques, tels que le chlore gazeux, l'hydroxyde de sodium, le sodium métallique, l'hydrogène gazeux et le carbonate de sodium. Il est également utilisé pour faire fondre la glace et la neige sur les autoroutes et les routes.