Exemple de phénomènes chimiques
Chimie / / July 04, 2021
La chimie étudie les éléments constitutifs de la matière, les composés qu'ils forment et leurs combinaisons possibles, les produits résultant de ces combinaisons et de leur structure, et les phénomènes qui produisent, accélèrent ou retardent ces modifications. UNE Un phénomène chimique est un phénomène dans lequel deux substances ou plus subissent un changement qui modifie leur structure interne, donnant lieu à une, deux substances ou plus, différent de la matière originale.
Contrairement aux phénomènes physiques, dans lesquels certaines propriétés des objets sont modifiées, mais ils sont toujours la même substance ou composé, dans les phénomènes physiques, la structure des substances est altérée, laissant en conséquence d'autres substances différentes de originaux. C'est-à-dire que tous les phénomènes chimiques sont des réactions chimiques, qui aboutissent à une ou plusieurs substances qui sont moléculairement différentes de la ou des substances d'origine.
Types de phénomènes chimiques :
Les phénomènes chimiques peuvent être classés par rapport au résultat comme suit :
La synthèse
Deux ou plusieurs composés se rejoignent pour former un composé plus complexe.
Décomposition
Un composé complexe se décompose pour former des molécules plus simples.
Déplacement
L'un des éléments ou un radical des molécules réagissantes devient une partie de l'autre molécule avec laquelle il réagit.
Double défilement
Les molécules réagissantes échangent un élément ou un radical, donnant naissance à deux molécules différentes contre lesquelles elles réagissent.
Maintenant, concernant les réactions en tant que phénomènes chimiques, nous pouvons mentionner ce qui suit :
Oxydation
L'oxydation est une réaction dans laquelle l'oxygène se combine avec un autre élément, donnant un oxyde, dans le cas des métaux, et un oxy-acide s'il se combine avec des éléments non métalliques. La réaction est lente et la température du matériau n'augmente pas.

La combustion
La combustion est une forme d'oxydation rapide, dans laquelle la lumière et la chaleur sont également émises, c'est-à-dire qu'il s'agit d'une réaction exogène.
Alcalinisation
C'est lorsqu'un métal se combine avec un radical hydroxyle (radical avec la forme -OH).
Acidification
C'est lorsqu'un élément non métallique est combiné avec de l'hydrogène
Neutralisation
C'est la combinaison d'un hydroxyde avec un acide, entraînant la formation d'eau et d'un sel.
Réduction
C'est l'élimination de l'oxygène d'un oxyde, pour obtenir le métal pur, par réaction avec l'hydrogène d'un acide.
Ionisation
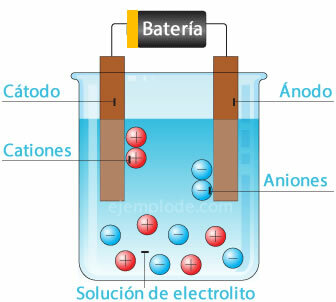
Lors de la dissolution d'un sel dans l'eau, les éléments qui le composent sont séparés en atomes avec des charges électriques, qui peuvent être positives (cation) ou négatives (anion). Ces types de solutions sont appelés électrolytes.
Électrolyse
Lorsqu'un courant électrique traverse un électrolyte, l'électricité provoque la rupture des atomes de l'eau. l'ion hydrogène, avec une charge positive, allant au pôle négatif (cathode), et l'oxygène, avec une charge négative, allant au pôle positif (anode). Lorsque l'électrolyse est appliquée dans un acide, l'un des effets est de déplacer l'élément métallique vers l'anode.
Catalyse
Deux substances qui, dans des conditions générales, ne réagissent pas, ou le font très lentement, peuvent réagir en très rapidement en présence d'une troisième substance, qui ne subira aucune modification ni avant ni pendant la réaction. Ce type de substance est appelé catalyseur.
Fermentation
C'est l'obtention d'une transformation chimique, notamment dans les composés organiques, par l'action de bactéries.
Exemple de phénomènes chimiques :
1. Une grille non peinte sera en contact avec l'oxygène de l'air et de l'eau et commencera à montrer de la rouille (oxydation)
2. Rapprocher un bois du feu le fera brûler, provoquant certaines des molécules de carbone qui le composent à mélanger rapidement avec de l'oxygène, libérant du dioxyde de carbone, laissant du bois brûlé et de la suie comme résidu (la combustion)
3. La décomposition des aliments est due à l'action digestive des bactéries, qui modifient la structure chimique des composants. (Fermentation).
4. La batterie de voiture produit de l'électricité par la réaction entre l'électrolyte et les cellules métalliques avec lesquelles elle est formée, provoquant la libération d'ions qui produisent de l'électricité. Pour le charger, le flux de courant effectue une action électrolytique qui renvoie les ions vers les plaques.
5. Les gaz produits par le moteur automobile, sont stables et se décomposent difficilement après avoir quitté le moteur et atteint la température ambiante. Le pot catalytique contient une mousse de platine qui, lorsqu'elle est chauffée à environ 500°C, permettre aux gaz de se décomposer en composés plus simples, sans que le platine soit modifications.
6. En dissolvant le sel dans l'eau, il se divise en ions sodium et chlore.
7. Le pétillement qui se produit lorsque vous mélangez du jus de citron avec du bicarbonate de soude est une réaction de neutralisation.
8. Lorsque nous saignons, le sang prend une couleur plus foncée, en raison de l'oxydation du fer présent dans les globules rouges. C'est aussi pourquoi le sang veineux est plus foncé et le sang artériel plus brillant.
9. Le chromage des pièces automobiles utilise l'électrolyse pour déposer le chrome sur la pièce métallique en cours de chromage.
10. Dans la digestion en tant que phénomène chimique, l'action de l'acide chlorhydrique sur les aliments est de décomposer les molécules complexes qui les forment, en molécules plus petites qui peuvent être plus facilement absorbées dans le intestin.

