Exemple de chimie organique
Chimie / / July 04, 2021
La Chimie organique C'est la partie de la Chimie Générale chargée de l'étude et de la classification fonctionnelle des composés chimiques dont l'élément de structure est le Carbone, présent en abondance dans le matière vivante; Cela crée un univers très différencié de la chimie inorganique, dédié aux composés chimiques classés comme minéraux.
L'atome de carbone a quatre électrons dans la dernière couche de sa configuration électronique. Cette caractéristique, ainsi que celle de son rayon atomique, lui permet d'être relié par des liaisons covalentes à d'autres atomes d'un même élément, en de nombreuses chaînes, formant une grande diversité de composés chimiques stable.
Tu peux vérifier Des liaisons covalentes.
De tels composés chimiques, en plus des atomes de carbone qui leur donnent leur structure primordiale, contiennent des atomes d'hydrogène comme complément principal de la valence du carbone. De plus, dans cette diversité de composés, il y a ceux avec l'intervention d'atomes d'oxygène, Azote, Halogènes, Soufre et même Phosphore, éléments alcalins et alcalino-terreux et métaux de transition. Selon qui est impliqué dans la molécule, ce seront les propriétés physiques et chimiques de la substance finale.
Les composés organiques sont présents tout au long du matière vivante; promouvoir et soutenir tous fonctions biologiques, contrairement aux substances inorganiques ou minérales, qui ont été utilisées par l'homme à des fins commerciales, à des fins d'expérimentation ou pour accomplir certaines tâches domestiques.
Histoire de la chimie organique
Avant 1828, la distinction était déjà faite entre la chimie organique et la chimie inorganique. La matière organique a été associée à une création à travers un "force vital", et à l'inorganique avec le non-vivant, avec le minéral. Compte tenu de ces conceptions, on ne pouvait s'attendre à obtenir des composés organiques à partir de matériaux inorganiques en laboratoire.
Cependant, en 1828 Friedrich Wöhler (1800-1882) a réussi à préparer une substance organique, Urée CO (NH2)2, un produit important du métabolisme animal, à partir de composés inorganiques. Traitement Cyanate de plomb Pb (CNO)2 avec Ammoniac NH3 pour obtenir Cyanate d'ammonium NH4CNO; Ce composé s'est formé, en effet, mais lorsque la solution a été bouillie pour cristalliser le cyanate d'ammonium, elle s'est transformée en urée.
Ce changement chimique est un exemple de Regroupement interne, dans lequel le nombre ou la classe d'atomes de la molécule ne change pas, mais seulement leur ordre au sein de celle-ci. Ces types de transformations sont très fréquents en chimie organique.
La découverte de Wöhler a initié l'abandon de la théorie de la force de vie, plus tard complètement rejetée en étant suivie de la préparation de nombreux autres composés organiques dans le laboratoire. Malgré cela, les qualificatifs d'Inorganique et Organique subsistent, puisque les composés inorganiques sont liés aux produits minéraux et les composés organiques, qui sont en fait des composés de carbone et d'hydrogène et leurs dérivés, sont du type produit par les organismes vivants.
Quoique les lois de la chimie générale s'appliquent également aux deux composés, diverses causes justifient et rendent nécessaire cette division. Ainsi, les composés organiques et inorganiques diffèrent par des propriétés différentes, telles que: leur Solubilité préféré dans les solvants organiques (éther, alcool, chloroforme, etc.) et dans l'eau, respectivement, son Stabilité (les composés organiques se décomposent à des températures relativement basses), et le Nature des réactions; pour les composés inorganiques ils sont ioniques, simples et pratiquement instantanés, et pour les composés organiques ils sont covalents, complexes et lents.
Composés organiques
Des composés carbonés avec des chaînes jusqu'à quatre-vingt-dix atomes sont connus. le chaînes Les atomes de carbone peuvent être linéaire et ramifié et ont des liaisons covalentes simples ou ont des liaisons doubles ou triples. Plus de 2 500 composés sont connus pour ne contenir que du carbone et de l'hydrogène (Hydrocarbures).
Isomérie des composés organiques
Dans les composés inorganiques, une formule représente généralement un seul composé; ainsi, il n'y a qu'une seule substance de formule H2SW4. La molécule d'acide sulfurique contient deux atomes d'hydrogène, un de soufre et quatre d'oxygène, dans un arrangement spécifique et unique. Dans les composés organiques, il est rare que cela se produise. Ainsi, par exemple, il existe deux composés qui répondent à la formule C2H6Ou, l'alcool éthylique ou l'éthanol, et l'éther diméthylique.

Plus la molécule est complexe, c'est-à-dire plus le nombre d'atomes de carbone est grand, plus le nombre d'isomères possibles est grand.
Analyse des composés organiques
L'analyse d'un composé organique comprend la analyse qualitative, les analyse quantitative et le Analyse fonctionnelle. Dans le cas où l'on suppose que le composé est à l'état impur, il est préalablement purifié par Cristallisation, Distillation, Sublimation, Extraction, etc. Le critère de pureté peut être jugé sur la base de ses constantes physiques, telles que le point de fusion, le point d'ébullition, la densité, la solubilité, la forme cristalline, l'indice de réfraction, etc.
le analyse qualitative Elle est vérifiée en recherchant la présence des éléments qui composent le composé, notamment le Carbone, l'Hydrogène et l'Azote, et parfois les Halogènes, le Soufre et le Phosphore.
le analyse quantitative Elle est réalisée en utilisant comme base les méthodes utilisées pour l'analyse qualitative. Le point de départ est une certaine quantité de substance qui subit une combustion, et le dioxyde de carbone est collecté et pesé. carbone et vapeur d'eau formés pour calculer le pourcentage de carbone et d'hydrogène dans le composé. Les résultats de l'analyse quantitative facilitent le calcul de la formule empirique, bien que la formule moléculaire ne puisse être trouvée qu'après la détermination du poids moléculaire de la substance. Mais le problème n'est pas encore résolu, car une même formule moléculaire peut correspondre à différents isomères.
Classification des composés organiques
Selon leur structure, les composés organiques sont divisés en composés aliphatique, aromatique Oui hétérocyclique. Les composés aliphatiques sont liés au méthane CH4, sont à chaîne ouverte, à l'exception des cycloparaffines, et doivent leur nom au fait que les graisses animales et végétales appartiennent à ce groupe.
Les composés aromatiques, chaîne fermée, étroitement liée au benzène, C6H6, et ils doivent leur nom au fait que beaucoup d'entre eux ont des odeurs parfumées et agréables.
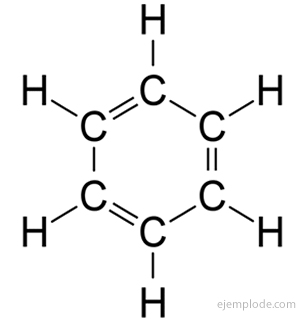
Anneau de benzène
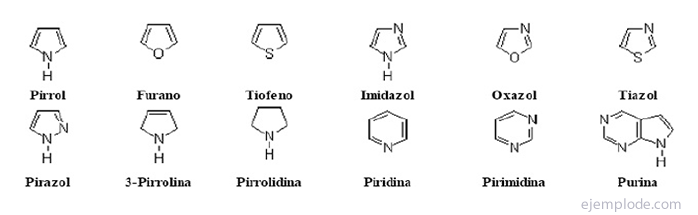
Les composés hétérocycliques Ce sont des composés à chaîne fermée dans lesquels il y a un élément autre que le carbone dans le cycle.
Par leur constitution, ils sont :
Hydrocarbures, qui à son tour, en raison du type de liens qu'il a, est classé comme Alcanes, Alcènes Oui Alcynes. De plus, les Cycloalcanes, le Benzène et leurs dérivés composés uniquement de Carbone et d'Hydrogène font partie de cette catégorie.
Composés hétérocycliques
Dérivés halogénés :R-X
Composés nitro :R-NON2
Acides sulfoniques :R-SO3H
Nitriles (OU cyanures d'alkyle) et Isonitriles :R-CN et R-NC. Ils diffèrent par la manière dont l'atome d'azote est lié à la molécule.
Alcools :R-OH
Phénols : Composés à base d'un squelette constitué d'un cycle benzénique avec un groupe hydroxyle ajouté.

Éthers :R-O-R
Mercaptans: R-SH
Thioéthers :R-S-R
Thioacides :R-COSH
Aldéhydes :R-CHO
Cétones :R-CO-R
Acides carboxyliques:R-COOH
Vous sortez:R-COOM (M pour métal)
Esters: R-COO-R
Anhydrides: R-CO-O-OC-R
Amines :R-NH2, R-NH-R, 2R-N-R
Glucides de type Aldosa :-CHOH-CHOH-CHO
Glucides de type cétose :-CHOH-CO-CH2Oh
Composés organométalliques :R-M-R
Halogénures de métal-alkyle :R-MX (également connu sous le nom de réactifs de Grignard)


