Exemple de la loi de Charles
La Physique / / July 04, 2021
La loi des gaz de Charles ou loi de pression constante, est une autre des lois des gaz, énoncée par Gay-Lussac, qui a publié l'ouvrage de Jacques Charles, publié vers 20 années avant.
La loi de Charles prédit le comportement d'une masse de gaz lorsque la pression reste constante et que la température et le volume varient.
La loi de Charles s'énonce ainsi :
A pression constante, le volume d'un gaz est directement proportionnel à la variation de sa température.
Pression constante: fait référence au fait que la pression que le gaz exerce sur les parois du récipient ne variera pas tout au long de l'expérience.
Le volume: c'est l'espace occupé qu'occupe le gaz, en général il est considéré comme un récipient dont les parois ne se déforment pas, et dont le couvercle fonctionne comme un piston.
Température: C'est l'augmentation ou la perte de chaleur que subit le gaz pendant l'expérimentation. Si la température augmente, le volume augmente. Si la température diminue, le volume diminue également.
Algébriquement, la loi de Charles s'exprime par la formule suivante :

Où:
V = volume de gaz
T = température du gaz
k = constante de proportionnalité pour cette masse de gaz.
Cela signifie que pour une masse de gaz donnée, à pression constante, le rapport entre le volume et la variations de température, auront toujours la même relation de proportionnalité, représentée par la constante k :

Ainsi, une fois la constante déterminée, nous pouvons calculer n'importe laquelle des autres valeurs à partir des autres données connues :
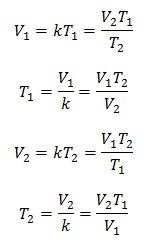
3 Exemples de la loi de Charles appliquée aux problèmes :
Exemple 1: Calculez le nouveau volume, si dans un récipient il y a une masse de gaz qui occupe un volume de 1,3 litre, à une température de 280 K. Calculez le volume lorsque vous atteignez une température de 303 K.
V1 = 1,3 l.
T1 = 280K
V2 = ?
T2 = 303K
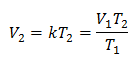
Valeurs de substitution :
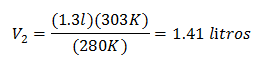
Le nouveau volume à 303 K est de 1,41 litre.
Exemple 2. Si nous avons un gaz qui occupe 2,4 litres à 10 degrés Celsius, calculez la température finale, si à la fin il occupe 2,15 litres.
V1 = 2,4 l
T1 = 10 °C = 283K
V2 = 2,15 l
T2 = ?
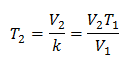
Valeurs de substitution :
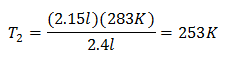
La nouvelle température est de 253 K, ce qui équivaut à -20°C.
Exemple 3. Nous avons un gaz dont la température initiale est de 328 K, son volume final est de 3,75 l et sa constante de rapport est de 0,00885.
V1 = ?
T1 = 328 K
V2 = 3,75 l
T2 = ?
k = 0,00885
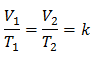
Valeurs de substitution :
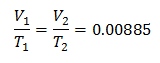
Pour connaître le Volume Initial :
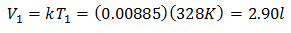
Le volume initial est de 2,90 l.
Pour connaître la température finale :
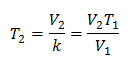
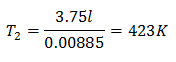
La température finale sera de 423 K, ce qui équivaut à 150 ° C.

