समाधान के ५० उदाहरण
अनेक वस्तुओं का संग्रह / / July 04, 2021
समाधान के प्रकारों में से एक हैं मिश्रण मौजूद है। समाधान बनाने वाले घटक रासायनिक रूप से प्रतिक्रिया नहीं करते हैं, हालांकि इन घटकों के भौतिक गुणों को समाधान का हिस्सा बनने पर संशोधित किया जा सकता है। उदाहरण के लिए: धूम्रपान, अमलगम, दूध के साथ कॉफी।
किसी मिश्रण का विलयन बनने के लिए, यह होना चाहिए सजातीय यू UNIFORM, अर्थात्, मिश्रित घटकों को नग्न आंखों से अलग नहीं किया जा सकता है और इसके अलावा, विलेय (एक पदार्थ जो कम मात्रा में दिखाई देता है) और के बीच का अनुपात विलायक (पदार्थ जो अधिक मात्रा में प्रकट होता है) विलयन से जो भी आयतन लिया जाता है, उसमें लगभग अपरिवर्तित रहता है। घोल में या विलायक में विलेय का अनुपात "एकाग्रता" कहलाता है और आमतौर पर विलेय की विभिन्न सांद्रता का उपयोग करके एक ही घोल तैयार किया जा सकता है।
उन पदार्थों के बीच समाधान बन सकते हैं, जो मिश्रित होने से पहले, किसी भी भिन्न में होते हैं एकत्रीकरण राज्य. व्यावहारिक रूप से एकत्रीकरण के सभी राज्यों में समाधान हैं। आम तौर पर, समाधान के एकत्रीकरण की स्थिति विलायक के एकत्रीकरण की स्थिति से निर्धारित होती है। उदाहरण के लिए:
के लिए यह आम है
अणुओं की उपस्थिति एक विलायक के भीतर विलेय की मात्रा स्वयं विलायक के गुणों को बदल देती है। उदाहरण के लिए, जब इन यौगिकों को मिलाया जाता है, तो दो यौगिकों के गलनांक और क्वथनांक बदल जाते हैं, जैसा कि उनकी संरचना में हो सकता है। घनत्व और रंग।फ्रांसीसी वैज्ञानिक रॉल्ट समाधान में घटकों के इस व्यवहार का अध्ययन किया और इसके मुख्य कानून (रूल्ट्स लॉ) को भी प्रस्तावित किया। जिसमें कहा गया है कि एक आदर्श घोल के आसपास के वाष्प मिश्रण में प्रत्येक घटक का आंशिक वाष्प दाब pressure से तरल पदार्थ यह विलयन में प्रत्येक शुद्ध घटक के मोल अंश के आंशिक दबाव के बराबर है। एक आदर्श समाधान वह समाधान माना जाता है जिसमें रासायनिक प्रजातियां बहुत समान होती हैं, इसलिए उनके बीच की बातचीत की ऊर्जा में कोई भिन्नता नहीं मानी जाती है। रॉल्ट के नियम का मौलिक समीकरण है:
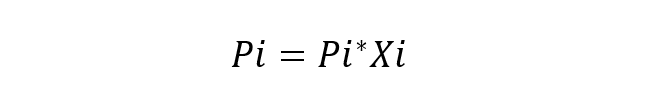
कहा पे:
- अनुकरणीय घटक का आंशिक दबाव है मैं समाधान के आसपास के गैसीय मिश्रण में।
- पाई* घटक का दबाव है मैं
- क्सी घटक का मोल अंश है मैं विघटन में।
जाहिर है, लोग स्थायी रूप से समाधान के संपर्क में हैं। वायु में तत्वों का विघटन है गैसीय अवस्था: इसकी बहुसंख्यक रचना द्वारा दी गई है नाइट्रोजन (७८%) और शेष पर २१% का कब्जा है ऑक्सीजन और 1% अन्य घटक, हालांकि ये अनुपात थोड़ा भिन्न हो सकते हैं।
समाधान के उदाहरण
निम्नलिखित सूची में समाधान के चालीस उदाहरण शामिल हैं, जिसमें एकत्रीकरण की स्थिति पर प्रकाश डाला गया है जिसमें प्रत्येक पाया जाता है, एक संबंधित विलायक में एक विलेय।
- वायु (गैस में गैस)। गैसों का एक संघटन, जहाँ नाइट्रोजन सबसे प्रचुर मात्रा में है
- धुआं (गैस में ठोस)। आग से निकलने वाले धुएं के रूप में हवा बासी है। यह एक ऐसा विलयन है जिसमें वायु विलायक के रूप में कार्य करती है।
- धातुओं के बीच मिश्र धातु (ठोस में ठोस)। Duralumin एल्यूमीनियम, तांबा, मैंगनीज, मैग्नीशियम और सिलिकॉन से बना एक मिश्र धातु है।
- वायुमंडलीय वायु धूल (गैस में ठोस)। गैस में ठोस (लगभग एक अविभाज्य इकाई में विघटित लेकिन अंत में ठोस) की उपस्थिति इस अर्थ में विघटन का एक उदाहरण है।
- इस्पात (ठोस में ठोस)। मिश्र धातु लोहे और कार्बन के बीच, पूर्व के अनुपात में बहुत अधिक है।
- कार्बोनेटेड ड्रिंक्स (तरल में गैस)। कार्बोनेटेड पेय में तरल में गैसों का विघटन होता है।
- मिश्रण (ठोस में तरल)। वे पारा के मिश्र धातु हैं जो निश्चित रूप से घुलते हैं धातुओं जैसे सोना या चाँदी।
- रिफाइंड पेट्रोलियम (तरल में तरल)। इसे बनाने वाले तत्वों का संयोजन (अधिकांश कार्बन है) तरल पदार्थों के बीच एक विघटन को जन्म देता है।
- हवा में ब्यूटेन (गैस में गैस)। ब्यूटेन एक है रासायनिक यौगिक गैसीय जिसे ट्यूबों में संग्रहित किया जा सकता है, ईंधन के रूप में उपयोग करने के लिए तैयार है।
- समुद्र के पानी में ऑक्सीजन (तरल में गैस)। समुद्री जल का ऑक्सीकरण जलीय जीवन के विकास की अनुमति देता है।
- अल्कोहल सामग्री के साथ पेय (तरल में तरल)। उत्सवों में इनका सेवन मनुष्यों द्वारा बहुत किया जाता है। वे आम तौर पर इथेनॉल और फलों के रस के नियंत्रित सांद्रता में समाधान होते हैं शराब.
- दूध वाली कॉफी (तरल में तरल)। एक उच्च सामग्री वाला तरल दूसरे से थोड़ा प्राप्त करता है, जो उसके रंग और स्वाद के परिवर्तन का प्रतिनिधित्व करता है।
- धुंध (गैसों में गैस)। गैसों की शुरूआत जो वायुमंडल के लिए विशिष्ट नहीं हैं, हवा के परिवर्तन को प्रेरित करती हैं, जो इसका उन समाजों पर नकारात्मक प्रभाव पड़ता है जो इसे सांस लेते हैं: जितना अधिक केंद्रित होगा, उतना ही हानिकारक होगा।
- पानी में नमक (द्रव में ठोस)। व्यापक रूप से खाना पकाने के लिए उपयोग किया जाता है।
- रक्त (तरल में तरल)। बहुसंख्यक घटक प्लाज्मा (तरल) है और इसके भीतर अन्य तत्व दिखाई देते हैं, जिनमें से लाल रक्त कोशिकाएं बाहर खड़ी होती हैं।
- पानी में अमोनिया (तरल में तरल)। यह घोल (जिसे गैस से तरल में भी बनाया जा सकता है) कई सफाई आपूर्ति के लिए कार्यात्मक है।
- नमी के निशान के साथ हवा (गैस में तरल)। वायु में जलवाष्प बढ़ने के कारण उपस्थित होता है तापमान.
- पाउडर जूस (द्रव में ठोस)। पाउडर पानी में घुल जाता है और पाउडर के रस के रंग का घोल बनाता है।
- पैलेडियम में हाइड्रोजन (ठोस में गैस)। कुछ धातुओं में हाइड्रोजन बहुत अच्छी तरह घुल जाती है।
- हवाई वायरस Virus (गैस में ठोस)। वायुमंडलीय धूल की तरह, वे एक ठोस की बहुत छोटी इकाइयाँ हैं जिन्हें गैस द्वारा ले जाया जाता है।
- चांदी में बुध (ठोस में तरल)। यह तथाकथित "अमलगम्स" में से एक है।
- चाय (द्रव में ठोस)। बहुत छोटे आयामों में एक ठोस (लिफाफे के ग्रेनाइट) पानी पर घुल जाता है।
- शाही पानी (तरल में तरल)। यह की एक रचना है अम्ल यह विभिन्न धातुओं को भंग करने की अनुमति देता है, जिनमें से सोना दिखाई देता है।
- पीतल (ठोस में ठोस)। यह तांबे और टिन के बीच मिश्र धातु है।
- नींबू पानी (तरल में तरल। हालांकि कई बार मिश्रण एक ठोस और एक तरल के बीच होता है, यह वास्तव में उस ठोस में मौजूद तरल होता है, जैसे कि नींबू का रस।
- पेरोक्साइड (तरल में तरल)। यह हाइड्रोजन परॉक्साइड (H .) का विलयन है2या2) पानी में। इसका उपयोग घावों को कीटाणुरहित करने और कॉस्मेटिक उद्योग में किया जाता है।
- पीतल (ठोस में ठोस)। यह ठोस तांबे और जस्ता के बीच मिश्र धातु है।
- आइस कूलिंग (द्रव में ठोस)। बर्फ तरल में प्रवेश करती है और घुलते समय इसे ठंडा करती है। यदि इसे पानी में पेश किया जाता है, तो यह विशेष मामला है जिसमें यह वही पदार्थ होता है।
- शारीरिक समाधान (तरल में तरल)। पानी एक विलायक के रूप में कार्य करता है और कई तरल पदार्थ एक विलेय के रूप में कार्य करते हैं।
- स्मूदी (द्रव में ठोस)। पीसने की प्रक्रिया के माध्यम से, ठोस से तरल पदार्थ का संयोजन प्रेरित होता है।
साथ में पीछा करना:

