डाल्टन का नियम उदाहरण
रसायन विज्ञान / / July 04, 2021
अंग्रेजी वैज्ञानिक जॉन डाल्टन (1766-1844) एक भौतिक विज्ञानी और रसायनज्ञ थे जिन्होंने तत्वों और रसायनों के संपीड़न और वर्गीकरण में कई योगदान दिए। उनके मुख्य योगदानों में से एक ग्राफिक प्रतिनिधित्व के माध्यम से परमाणुओं और यौगिकों के प्रतिनिधित्व का पहला मॉडल है। उन्होंने तथाकथित "एकाधिक अनुपात का कानून" भी तैयार किया, जिसे डाल्टन के कानून के रूप में भी जाना जाता है।
रासायनिक संयोजनों पर, लुई प्राउस्ट (1754-1826) ने "निरंतर अनुपात का कानून" तैयार किया, जिसमें उन्होंने एकत्र किया यह अवलोकन कि रसायन हमेशा समान अनुपात में संयोग करके समान यौगिक बनाते हैं। यानी, अगर हाइड्रोजन और ऑक्सीजन को मिला दिया जाए, तो वे हमेशा एक ही अनुपात में मिलकर पानी पैदा करेंगे। हालांकि, इस कानून ने यह नहीं बताया कि एक ही पदार्थ से बने विभिन्न यौगिक कैसे थे।
अपने परमाणु सिद्धांत के साथ, डाल्टन ने महसूस किया कि जब कुछ सरल पदार्थ संयुक्त होते हैं, तो वे कर सकते हैं विभिन्न यौगिकों का उत्पादन होता है और किसी एक पदार्थ की मात्रा अनुपात में भिन्न होती है सरल।
डाल्टन का नियम इस प्रकार कहा गया है: एक तत्व का भार जो दूसरे की समान मात्रा से जुड़कर विभिन्न रासायनिक यौगिक बनाता है, एक बहुत ही सरल संबंध के अनुसार भिन्न होता है
.इसका अर्थ यह है कि यदि हम जानते हैं कि पदार्थों को सरल अनुपात में कैसे संयोजित किया जाता है, और पदार्थों में से एक की मात्रा स्थिर रहती है और दूसरी हम इसे एक साधारण अनुपात में रखते हैं, मूल अनुपात के संबंध में 2, 3 या 4 के अनुपात के रूप में, प्रत्येक मामले में हम एक पदार्थ प्राप्त करेंगे विभिन्न। यह उदाहरण के लिए होता है, जब फॉस्फोरस, हाइड्रोजन और ऑक्सीजन का संयोजन होता है।
यदि हम फॉस्फोरस की 1 मात्रा, हाइड्रोजन की 3 मात्रा और ऑक्सीजन की 2 मात्रा को मिलाते हैं, तो हमें हाइपोफॉस्फोरिक एसिड प्राप्त होगा:
पी + 3 एच + 2 ओ -> पीओ2एच3
यदि पिछली प्रतिक्रिया में हम केवल ऑक्सीजन को 2 के साधारण अनुपात में बदलते हैं, तो हम फॉस्फोरिक एसिड प्राप्त करेंगे:
पी + 3 एच + 4 ओ -> पीओ4एच3
यह ध्यान में रखा जाना चाहिए कि इस समय परमाणु संयोजकता की अवधारणा अभी तक ज्ञात नहीं थी, इसलिए यह ठीक से ज्ञात नहीं था कि कुछ पदार्थों को चर अनुपात और अन्य में क्यों जोड़ा जा सकता है नहीं।
डाल्टन का नियम उदाहरण
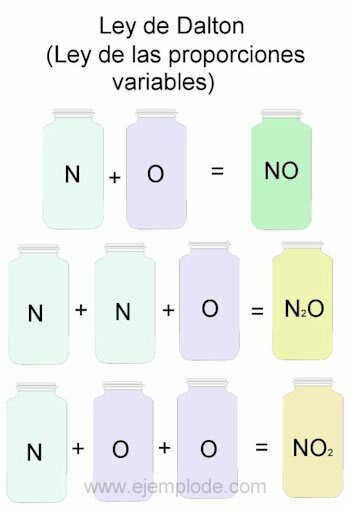
डाल्टन के नियम का उदाहरण देने के लिए, हम नाइट्रोजन (N) और ऑक्सीजन (O) के संयोजनों को संदर्भ के रूप में लेंगे।
जब उन्हें एक ही अनुपात में मिला दिया जाता है, यानी एक-एक करके, हमें नाइट्रिक ऑक्साइड मिलता है:
एन + ओ -> नहीं
यदि हम नाइट्रोजन की मात्रा को स्थिर रखते हैं और ऑक्सीजन को 2 से बदलते हैं, तो हमें नाइट्रोजन पेरोक्साइड प्राप्त होगा:
एन + 2 ओ -> नहीं2
यदि, नाइट्रिक ऑक्साइड के आधार पर, अब हम ऑक्सीजन को स्थिर रखते हैं और नाइट्रोजन की मात्रा को 2 से बदलते हैं, तो हम नाइट्रस ऑक्साइड प्राप्त करेंगे:
2एन + ओ -> एन2या
अगर लेख आपके लिए उपयोगी था, तो हमें +1 देना न भूलें।



