इलेक्ट्रोलिसिस क्या है
रसायन विज्ञान / / July 04, 2021
रसायन विज्ञान में, इलेक्ट्रोलीज़ वह घटना है जिसमें एक आयनिक यौगिक के जलीय घोल से विद्युत धारा प्रवाहित होती है, और शुरू होता है आयनों को निर्देशित करें (आवेशित कण) यौगिक a. के दो इलेक्ट्रोडसकारात्मक (एनोड, ऋणात्मक रूप से आवेशित आयनों को आकर्षित करता है) और ऋणात्मक (कैथोड, धनावेशित धनायनों को आकर्षित करता है)। यह घटना इलेक्ट्रोस्टैटिक्स के कानून द्वारा नियंत्रित होती है, जो इंगित करती है कि विपरीत शुल्क एक दूसरे को आकर्षित करते हैं।
इलेक्ट्रोलाइट्स
१८८३ में, माइकल फैराडे पता चला कि कुछ पदार्थों के जलीय विलयन विद्युत धारा का संचालन करते हैं, जबकि अन्य पदार्थों के विलयन में ऐसा नहीं होता है।
यह जांचने के लिए कि जलीय घोल विद्युत प्रवाह का संचालन करता है या नहीं, फैराडे ने एक साधारण उपकरण तैयार किया जिसमें a 110 वोल्ट डीसी सर्किट, एक चिराग, यू दो धातु या ग्रेफाइट इलेक्ट्रोड जुड़े हुए हैं वर्तमान स्रोत के लिए।
यदि इलेक्ट्रोड को पानी में डुबोया जाता है, तो प्रवाहित होने वाली धारा की मात्रा इतनी कम होती है कि दीपक जलता नहीं है; यदि वे चीनी के घोल में डुबोए जाते हैं तो भी यही सच है।
इसके विपरीत, यदि वे के घोल में डुबोए जाते हैं
सोडियम क्लोराइड NaCl या से हाइड्रोक्लोरिक एसिड एचसीl, दीपक तेज चमकता है, जो साबित करता है कि विघटन एक उत्कृष्ट संवाहक है. दूसरी ओर, एसिटिक एसिड CH. का उपयोग करते हुए3सांद्रित COOH, विलयन धारा को बुरी तरह से संचालित करता है, लेकिन जब अम्ल को जल H with से तनुकृत किया जाता है2या, इसकी विद्युत चालकता बढ़ जाती है।विभिन्न समाधानों के माध्यम से करंट के पारित होने के दौरान, इलेक्ट्रोड पर विभिन्न उत्पाद प्राप्त होते हैं।
इलेक्ट्रोलिसिस पर अपने अध्ययन के दौरान, फैराडे ने निम्नलिखित कानून निकाले:
पहला कानून: पदार्थ की मात्रा जिसका इलेक्ट्रोड में रासायनिक परिवर्तन होता है, समाधान से गुजरने वाली बिजली की मात्रा के समानुपाती होता है।
दूसरा कानून: यदि समान मात्रा में विद्युत को विभिन्न विलयनों से गुजारा जाए, तो पदार्थों का भार अलग-अलग इलेक्ट्रोड पर विघटित या जमा किए गए, उक्त के बराबर भार के समानुपाती होते हैं पदार्थ।
एक उदाहरण उद्धृत करने के लिए:
यह माना जाएगा कि आपके पास पांच अलग-अलग इलेक्ट्रोलाइटिक सेल हैं। के साथ पहला हाइड्रोक्लोरिक एसिड एचसीएल, दूसरा साथ कॉपर सल्फेट CuSO4, तीसरा साथ एंटीमोनियस क्लोराइड SbCl3, चौथा साथ स्टैनस क्लोराइड SnCl2 और पांचवें के साथ स्टैनिक क्लोराइड SnCl4.
उसी धारा को इलेक्ट्रोलाइटिक कोशिकाओं की एक श्रृंखला के माध्यम से पारित किया जाता है, जब तक कि 1,008 ग्राम हाइड्रोजन जारी नहीं किया जाता है (ए हाइड्रोक्लोरिक एसिड समाधान के हाइड्रोजन के बराबर वजन, एक ही समय में जारी अन्य उत्पादों के वजन (ग्राम में) वो हैं:
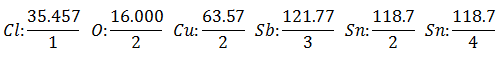
समान वज़न value का मान है तत्व के परमाणु भार को तत्व के वालेंसिया द्वारा विभाजित किया जाता है.
किसी भी वस्तु के बराबर वजन जारी करने के लिए, आपको चाहिए ९६५०० कूलम्ब. बिजली की इस मात्रा को कहा जाता है १ फैराडे.
फैराडे यूनिट
एम्पीयर को एक समान धारा के रूप में परिभाषित किया गया है जो सिल्वर नाइट्रेट (AgNO) के घोल से 0.001118 ग्राम सिल्वर (Ag) जमा करती है।3) क्षण भर में। चूँकि चाँदी का परमाणु भार 107.88 g/mol है, अनुपात १०७.८८ / ०.००१११८ देता है एम्पीयर-सेकंड या कूलम्ब्स की संख्या बिजली की आवश्यकता चांदी के रासायनिक समकक्ष जमा करने के लिए. यह मात्रा ९६४९४ कूलम्ब्स है (९६५०० का मान सरल गणनाओं के लिए मोटा है), और इसे बिजली का १ फैराडे कहा जाता है।
इलेक्ट्रोड
फैराडे ने बुलाया एनोड से पॉजिटिव इलेक्ट्रोड, और कैथोड से नेगेटिव इलेक्ट्रोड. उन्होंने आयनों और धनायनों को भी बनाया, जो इलेक्ट्रोलिसिस के दौरान क्रमशः एनोड और कैथोड पर दिखाई देने वाले पदार्थों पर लागू होते हैं।
वर्तमान में, इलेक्ट्रोड के लिए एक और परिभाषा है:
एनोड: इलेक्ट्रोड जिसमें इलेक्ट्रॉनों की हानि या ऑक्सीकरण होता है।
कैथोड: इलेक्ट्रोड जिसमें इलेक्ट्रॉन लाभ या कमी होती है।
इलेक्ट्रोलाइट्स और गैर-इलेक्ट्रोलाइट्स
समाधान के माध्यम से विद्युत प्रवाह के संचालन को 1887 तक संतोषजनक ढंग से समझाया नहीं गया था, जब स्वंते अरहेनियस ने अपने सिद्धांत को ज्ञात किया था। अरहेनियस सिद्धांत की सराहना करने और समझने से पहले, हमने सबसे पहले कुछ ऐसे तथ्य निर्धारित किए जो विज्ञान को तब ज्ञात थे जब अरहेनियस ने इसे तैयार किया था:
गैर-इलेक्ट्रोलाइट समाधान उनके पास ऐसे गुण हैं जिनकी गणना राउल्ट के नियम को लागू करके की जा सकती है। वाष्प के दबाव और इन समाधानों के देखे गए क्वथनांक और हिमांक व्यावहारिक रूप से परिकलित मूल्यों के समान हैं।
राउल्ट का नियम बताते हैं कि विलयन में प्रत्येक विलेय का वाष्प दाब उसके स्वयं के मोल अंश पर निर्भर करता है, जो इसकी शुद्ध अवस्था में वाष्प दाब से गुणा होता है।

पानी में इलेक्ट्रोलाइट समाधान पर लागू होने पर राउल्ट का नियम विफल हो जाता है। वाष्प के दबाव और क्वथनांक और हिमांक की भिन्नताएं उपरोक्त कानून द्वारा अनुमानित की तुलना में हमेशा अधिक होती हैं, और इसके अलावा, वे पतला होने पर बढ़ जाती हैं।
इस तरह के विचलन को मान i द्वारा दर्शाया जाता है, जो हिमांक में परिकलित भिन्नता के बीच हिमांक में देखी गई भिन्नता का अनुपात है:

I का मान राउल्ट के नियम से विचलन का एक माप है, जब कोई विचलन नहीं होता है तो 1 के बराबर होता है।
इलेक्ट्रोलाइट्स की विद्युत चालकता
अरहेनियस ने जलीय इलेक्ट्रोलाइट समाधानों की चालकता की जांच की ताकि यह पता लगाया जा सके कि इलेक्ट्रोलाइट एकाग्रता के साथ चालकता कैसे भिन्न होती है।
इसने मोलर चालकता को मापा (जो भंग इलेक्ट्रोलाइट के एक मोल के अनुरूप चालकता है; अर्थात्, विशिष्ट चालकता एक मोल को संदर्भित करती है, और पाया कि यह कमजोर पड़ने के साथ बढ़ी है।
अरहेनियस ने अपने परिणामों की तुलना राउल्ट के नियम से विचलन के माप से की, और इन और मोलर चालकता के बीच घनिष्ठ संबंध पाया। उनके सिद्धांत में इलेक्ट्रोलाइट्स के व्यवहार की व्याख्या की गई है:
"इलेक्ट्रोलाइट अणु आयन नामक विद्युत आवेशित कणों में अलग हो जाते हैं। विघटन अधूरा है, और अणुओं और उनके आयनों के बीच एक संतुलन है। समाधान के भीतर चलते ही आयन करंट का संचालन करते हैं ”।
राउल्ट के नियम से विचलन अणुओं के आंशिक पृथक्करण के परिणामस्वरूप कणों की संख्या में वृद्धि के कारण होता है।
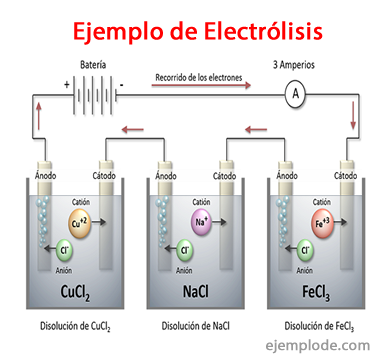
इलेक्ट्रोलिसिस के उदाहरण
कुछ समाधान जो इलेक्ट्रोलाइट्स की तरह व्यवहार करते हैं, यानी उनमें इलेक्ट्रोलिसिस की क्षमता होती है:
सोडियम क्लोराइड NaCl
हाइड्रोक्लोरिक एसिड एचसीएल
सोडियम सल्फेट Na2दप4
सल्फ्यूरिक एसिड एच2दप4
सोडियम हाइड्रोक्साइड NaOH Na
अमोनियम हाइड्रॉक्साइड NH4ओह
सोडियम कार्बोनेट Na2सीओ3
सोडियम बाइकार्बोनेट NaHCO3
नाइट्रिक एसिड HNO3
सिल्वर नाइट्रेट AgNO3
जिंक सल्फेट ZnSO4