रासायनिक बांड के प्रकार
रसायन विज्ञान / / July 04, 2021
जब दो या दो से अधिक परमाणु एक अणु बनाते हैं, तो वे a. के माध्यम से एक साथ जुड़ते हैं इलेक्ट्रॉनों के बीच जंक्शन इसकी अंतिम परतों में से, सबसे सतही। इस संघ को कहा जाता है रासायनिक बंध. एक रासायनिक बंधन बनाने के लिए, परमाणुओं में उनका होना चाहिए अधूरा अष्टकअर्थात् उनके अंतिम कोश में आठ से कम इलेक्ट्रॉन होते हैं, जो कि वह संख्या है जो उन्हें रासायनिक स्थिरता प्रदान करेगी।
रासायनिक बंधन तीन प्रकार के होते हैं:
- आयोनिक बांड
- सहसंयोजी आबंध
- धातु कड़ियाँ
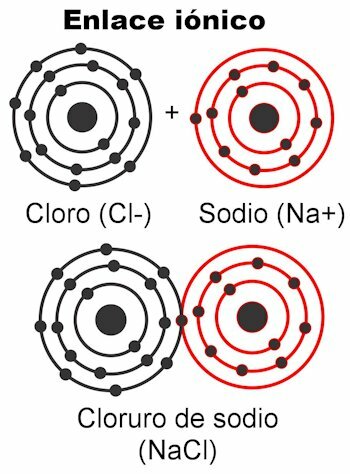
आयोनिक बांड
आयनिक बंध वे होते हैं जिनमें संयोजकता इलेक्ट्रॉन होते हैं इलेक्ट्रोस्टैटिक बलों द्वारा आकर्षित होते हैं. जिन परमाणुओं में 1 से 4 संयोजकता इलेक्ट्रॉन होते हैं, वे उन्हें बंधन बनाने के लिए वितरित कर सकते हैं; यह इसे एक धनात्मक आवेश देता है, क्योंकि यह ऋणात्मक आवेशों से छुटकारा दिलाएगा। दूसरी ओर, जिस परमाणु में ५ से ७ वैलेंस इलेक्ट्रॉन होते हैं, वे ८ तक पहुंचने के लिए आवश्यक इलेक्ट्रॉन प्राप्त कर सकेंगे।
इससे उन्हें ऋणात्मक आवेश प्राप्त होता है, क्योंकि वे इलेक्ट्रॉनों को ग्रहण करते हैं, जो ऋणात्मक होते हैं। तथ्य यह है कि इलेक्ट्रॉनों को पकड़ा या वितरित किया जा सकता है
परमाणुओं को विद्युत आवेश देता है. कूलम्ब के नियम के अनुसार, दोनों परमाणुओं पर आवेश बनते हैं वे एक दूसरे को एक बल के साथ आकर्षित करने जा रहे हैं, जो ऊपर वर्णित इलेक्ट्रोस्टैटिक्स है। ऋणात्मक आवेश धनात्मक आवेशों को आकर्षित करते हैं और इसके विपरीत। विपरीत शुल्क आकर्षित करते हैं. एक बार जब यह बल उन्हें एक साथ बांध देता है, तो अणु बन जाता है।आयनिक बंध अधिकतर होते हैं धातु और अधातु परमाणुओं के बीच. धातुएं अपने इलेक्ट्रॉनों को छोड़ देती हैं और हमेशा धनायन (+) के रूप में भाग लेते हुए एक धनात्मक आवेश धारण करती हैं। अधातु इलेक्ट्रॉन ग्राही होते हैं और आम तौर पर एक ऋणात्मक आवेश धारण करते हैं, इस रूप में भाग लेते हैं आयनों (-) लेकिन ऐसा भी होता है कि वे एक सकारात्मक चार्ज करते हैं, यह तब होता है जब वे चार्ज परमाणुओं के समूह बनाते हैं बुला हुआ कण, अमोनियम NH. के रूप में4+, कार्बोनेट CO3-2, फॉस्फेट पीओ4-3.
आयनिक बंधों द्वारा बनने वाले रासायनिक यौगिकों में से हैं:
- द्विआधारी लवण
- ऑक्सिलेस
जब ये पदार्थ पानी में घुल जाते हैं वे अलग कर देते हैं, अर्थात्, उनके विद्युत आवेशों में अलग और ये हाइड्रोजन आयन H. के साथ पानी में बिखर जाते हैं+ और हाइड्रॉक्सिल (OH .)-) जो पानी बनाते हैं। जो मिश्रण बनता है वह एक विलयन है जिसे. कहा जाता है इलेक्ट्रोलाइट.
- जारी रखें पढ़ रहे हैं: आयोनिक बंध
सहसंयोजी आबंध
सहसंयोजक बंधन वे होते हैं जिनमें इलेक्ट्रॉनों का साझा किया जाता है उन्हें परमाणु से अलग किए बिना, अर्थात्, विद्युत आवेशों के निर्माण के बिना। परमाणु निकटता से एक साथ रहते हैं और उस बल का उपयोग करते हैं जिसके साथ नाभिक इलेक्ट्रॉनों को आकर्षित करता है। एक बार बंधन बनने के बाद, परमाणुओं के दो या दो से अधिक नाभिक साझा इलेक्ट्रॉनों को आकर्षित करते हैं, जिससे ऑक्टेट नियम पूरा होता है और अणु स्थिर हो जाता है।
सहसंयोजक बंधन के कई रूप हैं, और वे हैं:
- सहसंयोजक बंधन
- समन्वय सहसंयोजक बंधन
- ध्रुवीय सहसंयोजक बंधन
- गैर-ध्रुवीय सहसंयोजक बंधन
सहसंयोजक बंधन यह ठीक वैसा ही है जैसा कि शुरुआत में बताया गया है। भाग लेने वाले परमाणु इलेक्ट्रॉनों को साझा करते हैं ताकि उन सभी का पूरा ऑक्टेट हो। यहां कोई विद्युत आवेश नहीं हैं, क्योंकि कोई इलेक्ट्रॉन बहाया नहीं जाता है, वे बस साझा किए जाते हैं।
में समन्वय सहसंयोजक बंधन यह केवल एक परमाणु है जो बंधन के लिए आवश्यक सभी इलेक्ट्रॉनों का योगदान देता है। दूसरा परमाणु बस एक साथ बांधता है और इन इलेक्ट्रॉनों को अपना लेता है। अणु इस तरह बनता है। यह मामला है, उदाहरण के लिए, सल्फ्यूरिक एसिड एच2दप4 जिसमें सल्फर ऑक्सीजन परमाणुओं के साथ इलेक्ट्रॉनों के दो जोड़े साझा करता है।
में ध्रुवीय सहसंयोजक बंधन, परमाणुओं के बीच की ताकतें अणु के एक तरफ झुकी होती हैं। यह जब विभिन्न प्रकार के परमाणु होते हैं अणु में। इस बल को डेबी इकाइयों में मापा जाता है, और अणु के एक तरफ इसका मूल्य जितना अधिक होगा, उतना ही अधिक ध्रुवीय होगा। इसका मतलब है कि संरचना में ध्रुवों का निर्माण होता है, और इसीलिए उन्हें यह नाम दिया गया है। इसके बल असममित हैं।
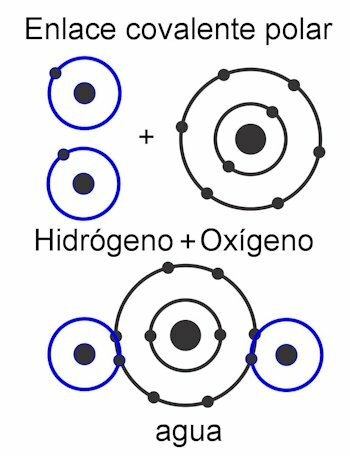
में गैर-ध्रुवीय सहसंयोजक बंधन, परमाणुओं के बीच बल पूरे अणु में समान होते हैं, और इसलिए इसकी संरचना में कोई ध्रुव नहीं बनता है। यह एक इकाई के रूप में कार्य करता है और इसलिए इसके भार को विभाजित करना बहुत कठिन, लगभग असंभव है। यह इसे पानी में अघुलनशील बनाता है। यह यौगिकों का मामला है जैसे हाइड्रोकार्बन, जिनके पूरे अणु में समान बल होते हैं। इसके बल सममित हैं।

- जारी रखें पढ़ रहे हैं: सहसंयोजक बंधन
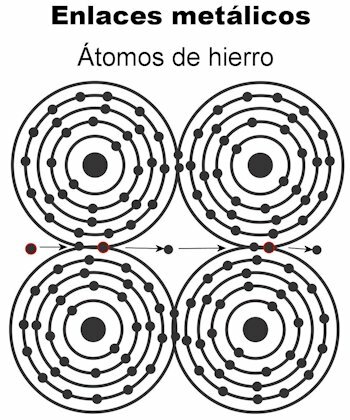
धात्विक बंधन
धातु के परमाणु धात्विक बंधों द्वारा आपस में जुड़े रहते हैं। इस प्रकार के बंधन में, सभी परमाणुओं के इलेक्ट्रॉन एक क्रिस्टलीय जाली बनाने के लिए आकर्षित होते हैं जो दृढ़ रहती है। क्रिस्टल जालक के बंधों में सभी इलेक्ट्रॉन परस्पर प्रतिच्छेदित होते हैं और विद्युत प्रवाह और गर्मी को ले जाने की व्यवस्था जब यह उन्हें प्रेषित किया जाता है। संक्रमण धातुओं में धात्विक बंधनों की यह संरचना अधिक उल्लेखनीय है, क्योंकि उनके परमाणु बड़े होते हैं।
आयनिक बंधन के उदाहरण
कुछ पदार्थ जो आयनिक बंध प्रस्तुत करते हैं वे हैं:
- NaCl सोडियम क्लोराइड। इसके आयन Na. हैं+ और क्लू-.
- पोटेशियम क्लोराइड KCl. इसके आयन K. हैं+ और क्लू-.
- कैल्शियम क्लोराइड CaCl2. इसके आयन Ca. हैं+2 और क्लू-.
- मैग्नीशियम क्लोराइड MgCl2. इसके आयन Mg. हैं+2 और क्लू-.
- स्ट्रोंटियम क्लोराइड SrCl2. इसके आयन श्री हैं+2 और क्लू-.
- बेरियम क्लोराइड BaCl2. इसके आयन Ba हैं+2 और क्लू-.
- एल्युमिनियम क्लोराइड AlCl3. इसके आयन अली हैं+3 और क्लू-.
- ना सोडियम सल्फेट2दप4. इसके आयन Na. हैं+ इसलिए4-2.
- पोटेशियम के सल्फेट2दप4. इसके आयन K. हैं+ इसलिए4-2.
- कैल्शियम सल्फेट CaSO4. इसके आयन Ca. हैं+2 इसलिए4-2.
- कैल्शियम सल्फेट MgSO4. इसके आयन Mg. हैं+2 इसलिए4-2.
- स्ट्रोंटियम सल्फेट SrSO4. इसके आयन श्री हैं+2 इसलिए4-2.
- बेरियम सल्फेट बेसो4. इसके आयन Ba हैं+2 इसलिए4-2.
- ना सोडियम फॉस्फेट3पीओ4. इसके आयन Na. हैं+ और पीओ4-3.
- पोटेशियम के फॉस्फेट3पीओ4. इसके आयन K. हैं+ और पीओ4-3.
- मैग्नीशियम फॉस्फेट Mg3(पीओ4)2. इसके आयन Mg. हैं+2 और पीओ4-3.
- कैल्शियम फॉस्फेट Ca3(पीओ4)2. इसके आयन Ca. हैं+2 और पीओ4-3.
- एल्युमिनियम फॉस्फेट AlPO4. इसके आयन अली हैं+3 और पीओ4-3.
- फेरस फॉस्फेट Fe3(पीओ4)2. इसके आयन Fe. हैं+2 और पीओ4-3.
- फेरिक फॉस्फेट FePO4. इसके आयन Fe. हैं+3 और पीओ4-3.
सहसंयोजक बंधन के उदाहरण
कुछ पदार्थ जो सहसंयोजक बंधन प्रस्तुत करते हैं वे हैं:
- मीथेन सीएच4.
- ईथेन सी2एच6.
- प्रोपेन सी3एच8.
- ब्यूटेन सी4एच10.
- पेंटेन सी5एच12.
- हेक्सेन सी6एच14.
- हेप्टेन सी7एच16.
- ओकटाइन सी8एच18.
- प्रोपलीन सीएच2= सीएच2-ch3.
- एसिटिलीन सी2एच2.
- मिथाइल अल्कोहल सीएच3
- एथिल अल्कोहल C2एच5
- प्रोपाइल अल्कोहल C3एच7
- आइसोप्रोपिल अल्कोहल सीएच3सीएच (ओएच) सीएच3.
- 2-प्रोपेनोन या एसीटोन सीएच3गाड़ी3.
- फॉर्मलडिहाइड एचसीएचओ।
- एसीटैल्डिहाइड सीएच3
- प्रोपियोनाल्डिहाइड सीएच3चौधरी2
- ब्यूटिराल्डिहाइड सीएच3चौधरी2चौधरी2
- फॉर्मिक एसिड HCOOH।
धातु बंधन के उदाहरण
कुछ पदार्थ जो धात्विक बंधन प्रस्तुत करते हैं वे हैं:
- जिंक Zn
- कैडमियम सीडी
- कॉपर क्यू
- सिल्वर एजी
- गोल्ड औ
- निकल नि
- पैलेडियम पीडी
- प्लेटिनम पीटी
- कोबाल्ट कंपनी
- रोडियम Rh
- इरिडियम गो
- आयरन फे
- रूथेनियम रु
- आज़मियम ओस
- मैंगनीज Mn
- क्रोमियम Cr
- मोलिब्डेनम Mo
- वोल्फ्राम वू
- वैनेडियम वी
- Zrconium Zr
साथ में पीछा करना:
- परमाणुओं
- आयन
- धातुओं
- कोई धातु नहीं
- हाइड्रोकार्बन
- समाधान
