Koncept u definiciji ABC
Miscelanea / / April 22, 2022
definicija pojma
Azeotropi su mješavine kemijskih spojeva, s definiranim sastavom, koji ključaju na određenim temperaturama. Osnovna karakteristika je da se smjesa ponaša kao da je jedna čista tvar, čuvajući svoja svojstva i pružajući jednostavnost rukovanja.

Inženjer kemije
Smjesu mogu dati dvije ili više komponenti i njezina sastav isto je i u tekućoj i u plinovitoj fazi, to stvara sličnosti s čistim tvarima. Iz ovoga se lako može zaključiti da se ova smjesa ne može razdvojiti na svoje komponente procesima kao npr frakcijske destilacije jer će, kao što je gore spomenuto, zadržati svoje proporcije, ponašajući se kao da je jedan komponenta.
Druga karakteristika je da vrelište ove smjese može biti viša, niža ili čak jednaka vrelištu jedne od njezinih komponenti. Kad azeotrop zavrije na a temperatura maksimalnog vrenja, poznat je kao maksimalni azeotrop, a kada to radi na najnižoj mogućoj temperaturi poznat je kao minimalni azeotrop. To znači da minimalni azeotrop ima nižu točku vrelišta od njegovih čistih komponenti i obrnuto s maksimalnim azeotropom. Na primjer, u smjesi metanol - benzen, azeotrop je minimalan (0,61 benzen - 0,39 metanol u frakcijama molar) čija je točka vrelišta 58 °C, u spremniku gdje je vrelište benzena 80 °C, a metanola 65°C
Minimalni i maksimalni azeotropi
Sada... odakle dolazi azeotrop? Kada postoji odstupanje od Zakon Raoult, to jest, tlak pare azeotropne smjese nije izravno povezan s njezinim molarnim udjelom, nego kada nastaje koncept azeotropne smjese. Ova odstupanja nastaju kada se komponente međusobno značajno privlače ili odbijaju, odnosno međumolekulske sile su vrlo različite u različitim spojevima.
Kada je odstupanje pozitivno, imamo minimalni azeotrop, dok ako je odstupanje negativno, imamo maksimalan azeotrop. Da bismo bolje razumjeli ovaj koncept, pogledajmo neke grafike:
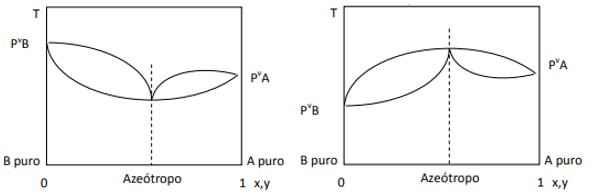
Ovdje primjećujemo da bi, ako bi smjesa bila idealna, prema Raoultovom zakonu, tlakovi pare čistih komponenti trebali biti spojeni ravnom linijom, budući da pa, postoji odstupanje od tog zakona koje uzrokuje stvaranje minimalnih i maksimalnih azeotropa, ovisno o tome postoji li veći ili manji afinitet između komponente. Kada je odstupanje od Raoultovog zakona negativno, kao na slici lijevo, ono je minimum na dijagram tlaka, ali maksimum u temperaturnom dijagramu (dakle, azeotrop maksimuma). S druge strane, ako je odstupanje pozitivno na Raoultov zakon, to će biti maksimum u tlaku vs. sastav, ali minimum u dijagramu temperature vs. sastav (ovdje imamo minimalni azeotrop). Nemojte brkati dijagrame tlaka i sastav i temperatura vs. sastav.
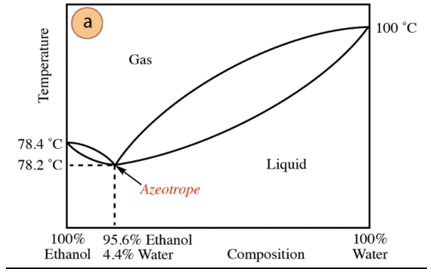
U slučaju smjese etanol-voda postoji minimalni azeotrop čiji je sastav 95,6% etanola i 4,4% vode. Temperatura vrenja azeotropne smjese je 78,2 °C niža od temperature vrenja čistih komponenti. Dakle, pretpostavimo destilaciju mješavine vode i etanola s visokim udjelom vode (blizu 100%). Neće biti moguće dobiti čisti alkohol, jer će se u svakoj fazi destilacije dobiti veće frakcije. etanola, ali nikada ne dosegnuvši 100%, postupno će se približavati sastavu azeotropne smjese (najniža točka pod, ispod). Zato, kao i voda, ima sklonost stvaranju minimalnih azeotropa organski spojevi (s obzirom na vrstu međumolekularnih sila koje djeluju), potrebno je prethodno ukloniti vodu iz smjese kako bi se dobio čisti spoj. Ili, nakon što se dobije azeotrop, metode izvlačenje dodatne vode.
Na temelju navedenog, nije slučajno pronaći alkohol (u samoposluzi i ljekarna) na 95% je najjeftiniji proizvod koji se može dobiti. Za dobivanje čistog alkohola potrebno je "razbiti" azeotrop s tehnika dodatno, kao što je upotreba sredstava za sušenje ili azeotropne destilacije. Azeotropska destilacija sastoji se od dodavanja dodatne komponente u smjesu koja djeluje povlačenjem i interakcija s bilo kojom od komponenti smjese (veći afinitet) može se ukloniti iz smjese.
Teme u Azeotropima


