Primjer organske kemije
Kemija / / July 04, 2021
The Organska kemija dio je Opće kemije zadužen za proučavanje i funkcionalnu klasifikaciju kemijskih spojeva čiji je strukturni element Ugljik, prisutna u izobilju u živa materija; tako nastaje svemir koji se dobro razlikuje od anorganske kemije, posvećen kemijskim spojevima klasificiranim kao minerali.
Atom ugljika ima četiri elektrona u posljednjoj ljusci svoje elektroničke konfiguracije. Ova karakteristika, zajedno s karakteristikom atomskog radijusa, omogućuje joj da se kovalentnim vezama poveže s drugima atomi istog elementa, u brojnim lancima, tvore veliku raznolikost kemijskih spojeva stabilan.
Mozes provjeriti Kovalentne veze.
Takvi kemijski spojevi, uz atome ugljika koji im daju svoju iskonsku strukturu, sadrže atome vodika kao glavnu nadopunu za valenciju ugljika. Osim toga, u ovoj raznolikosti spojeva postoje oni s intervencijom atoma kisika, Dušik, halogeni, sumpor, pa čak i fosfor, zemnoalkalijski i zemnoalkalijski elementi i metali tranzicija. Ovisno o tome tko je uključen u molekulu, to će biti fizikalna i kemijska svojstva konačne tvari.
The organski spojevi prisutni su kroz živa materija; promovirati i održavati sve biološke funkcije, za razliku od anorganskih ili mineralnih tvari, koje su ljudi koristili u komercijalne svrhe, za eksperimentiranje ili za ispunjavanje određenih domaćih zadaća.
Povijest organske kemije
Prije 1828. već se pravila razlika između organske kemije i anorganske kemije. Organska tvar bila je povezana sa stvaranjem kroz "vitalna sila"i anorganskim s neživim, s mineralima. S obzirom na ove koncepcije, nije se moglo očekivati da će se u laboratoriju dobiti organski spojevi iz anorganskih materijala.
Međutim, 1828. Friedrich Wöhler (1800. - 1882.) Uspio je pripremiti organsku tvar, Urea CO (NH2)2, važan proizvod metabolizma životinja, od anorganskih spojeva. Liječenje Olovni cijanat Pb (CNO)2 s Amonijak NH3 dobiti Amonijev cijanat NH4CNO; Taj je spoj doista nastao, ali kad je otopina prokuhala da kristalizira amonijev cijanat, transformirana je u uree.
Ova kemijska promjena je primjer Interno pregrupiranje, u kojem se broj ili klasa atoma u molekuli ne mijenja, već samo njihov poredak unutar nje. Ove su vrste transformacija vrlo česte u organskoj kemiji.
Wöhlerovo je otkriće kasnije iniciralo napuštanje teorije o životnoj snazi potpuno odbačen nakon čega slijedi priprema mnogih drugih organskih spojeva u laboratorija. Unatoč tome, kvalifikatori anorganskog i organskog egzistiraju, budući da su anorganski spojevi povezani s mineralnim proizvodima a organski spojevi, koji su zapravo spojevi ugljika i vodika i njihovi derivati, vrste su koju proizvode živi organizmi.
Iako se zakoni opće kemije jednako primjenjuju na oba spoja, različiti uzroci opravdavaju i čine ovu podjelu nužnom. Dakle, organski i anorganski spojevi razlikuju se u različitim svojstvima, kao što su: njihova Topljivost poželjno u organskim otapalima (eter, alkohol, kloroform, itd.), odnosno u vodi Stabilnost (organski spojevi se razgrađuju na relativno niskim temperaturama), a Karakter reakcija; za anorganske spojeve su ionski, jednostavni i praktički trenutni, a za organske spojeve kovalentni, složeni i spori.
Organski spojevi
Poznati su ugljikovi spojevi s lancima do devedeset atoma. The lanci Atomi ugljika mogu biti linearna i razgranata i imaju jednostruke kovalentne veze ili imaju dvostruke ili trostruke veze. Poznato je više od 2500 spojeva koji sadrže samo ugljik i vodik (Ugljikovodici).
Izomerija organskih spojeva
U anorganskim spojevima, formula općenito predstavlja jedan spoj; dakle, postoji samo jedna supstanca formule H2SW4. Molekula sumporne kiseline sadrži dva atoma vodika, jedan od sumpora i četiri od kisika, u specifičnom i jedinstvenom rasporedu. U organskim spojevima je rijetko da se to dogodi. Tako, na primjer, postoje dva spoja koji odgovaraju na formulu C2H6Ili, etilni alkohol ili etanol i dimetil eter.

Što je molekula složenija, odnosno što je veći broj atoma ugljika, to je veći broj mogućih izomera.
Analiza organskih spojeva
Analiza organskog spoja obuhvaća kvalitativna analiza, kvantitativna analiza i Funkcionalna analiza. U slučaju pretpostavke da je spoj u nečistom stanju, prethodno se pročišćava Kristalizacija, Destilacija, Sublimacija, Izvlačenjeitd. Kriterij čistoće može se prosuđivati na temelju njegovih fizičkih konstanti, poput točke taljenja, vrelišta, gustoće, topljivosti, kristalnog oblika, indeksa loma itd.
The kvalitativna analiza Potvrđuje se istraživanjem prisutnosti elemenata koji čine spoj, posebno ugljika, vodika i dušika, a ponekad i halogena, sumpora i fosfora.
The kvantitativna analiza Provodi se na osnovi metoda koje se koriste za kvalitativnu analizu. Polazna točka je određena količina tvari koja izgara, a ugljični dioksid se sakuplja i vaga. ugljika i vodene pare stvorene za izračunavanje postotka ugljika i vodika u vodi spoj. Rezultati kvantitativne analize olakšavaju izračunavanje empirijska formula, iako se molekularna formula može naći tek nakon određivanja molekularne težine tvari. Ali problem još nije riješen, jer ista molekularna formula može odgovarati različitim izomerima.
Klasifikacija organskih spojeva
Prema svojoj strukturi, organski se spojevi dijele na spojeve alifatski, aromatičan Y heterociklički. Alifatski spojevi povezani su s metanom CH4, su otvoreni lanci, osim cikloparafina, a svoje ime duguju činjenici da životinjske i biljne masti pripadaju ovoj skupini.
The aromatski spojevi, zatvoreni lanac, usko povezan s benzenom, C6H6, a svoje ime duguju činjenici da mnogi od njih imaju mirisne, ugodne mirise.
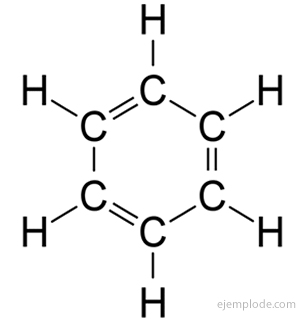
Prsten od benzena
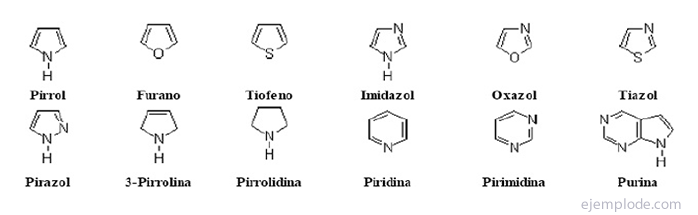
The heterociklički spojevi Oni su spojevi zatvorenog lanca u čijem se prstenu nalazi element koji nije ugljik.
Po svom ustavu oni su:
Ugljikovodici, koji je pak, zbog vrste poveznica koje ima, klasificiran kao Alkani, Alkeni Y Alkini. Uz to, u ovu su kategoriju cikloalkani, benzen i njihovi derivati koji se sastoje samo od ugljika i vodika.
Heterociklički spojevi
Halogenirani derivati:R-X
Nitro spojevi:R-NE2
Sulfonske kiseline:R-SO3H
Nitrili (ILI alkil cijanidi) i izonitrili:R-CN i R-NC. Razlikuju se po tome kako je atom dušika vezan u molekuli.
Alkoholi:R-OH
Fenoli: Spojevi na osnovi okosnice koja se sastoji od benzenskog prstena s dodanom hidroksilnom skupinom.

Eteri:R-O-R
Merkaptani: R-SH
Tioetri:R-S-R
Tiokiseline:R-COSH
Aldehidi:R-CHO
Ketoni:R-CO-R
Karboksilne kiseline:R-COOH
Izađi van:R-COOM (M za metal)
Esteri: R-COO-R
Anhidridi: R-CO-O-OC-R
Amini:R-NH2, R-NH-R, 2R-N-R
Ugljikohidrati tipa Aldosa:-CHOH-CHOH-CHO
Ugljikohidrati tipa ketoze:-CHOH-CO-CH2Oh
Organometalni spojevi:R-M-R
Metal-alkil halogenidi:R-MX (poznat i kao Grignard Reagensi)


