Primjer idealnih i stvarnih plinova
Fizika / / July 04, 2021
A Idealan plin je onaj čija svojstva poput Pokriveni tlak, temperatura i volumen, oni zadržavaju uvijek proporcija ili stalni odnos između njih. Drugim riječima, njegovo ponašanje slijedi Zakon o idealnom plinu, koji je predstavljen na sljedeći način:
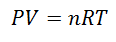
Da bismo došli do ove formule, započinjemo od La Opći zakon plinovite države, koji opisuje da postoji stalna veza između svojstava plina u svakom trenutku procesa. Svojstva o kojima se govori su Pritisak u sustavu u kojem je plin, Volumen koji zauzima plin i Temperatura plina.
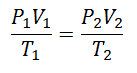
Prije ili kasnije odlučeno je oblikovati jednostavniji izraz, dajući konstantnosti slovo koje prati izraz:
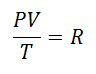
To se zvalo Univerzalna konstanta plina u faktoru R, a vrijednost mu je sljedeća:
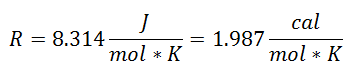
A budući da se Univerzalna plinska konstanta odnosi na svaki mol plina, Broj molova plina kao još jedan faktor, da pokrije svu supstancu prisutnu u sustavu tijekom procesa. Već ćemo imati konačnu jednadžbu u ovom obliku:
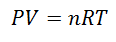
Gornja jednadžba je Zakon o idealnom plinu, a odnosi se na plinove koji su na temperaturi između umjerene i visoke. Dakle, bilo koja varijabla može se izračunati, a ostale odrediti.
Razlika između idealnih i stvarnih plinova
Ovaj zakon o idealnom plinu ne primjenjuje za plinove koji su na niske temperature ili blizu točke u kojoj postaju tekući.
Niske temperature rezultiraju a manje kretanje čestica plina i oni će se više taložiti zauzimajući drugačiji volumen nego kad su bili potpuno raspršeni.
Uz to, iz istog razloga, oni bi vježbali a Neravnomjeran pritisak u cijelom sustavu. Proporcionalnost će početi propadati i formula neće imati istu valjanost za izračune.
U tom slučaju treba koristiti stvarne jednadžbe plina.
A Pravi plin je onaj čija svojstva ne pridržavaju se točnih odnosa kao u Zakonu o idealnom plinu, tako se način izračunavanja ovih svojstava mijenja.
Jednadžbe stanja za stvarne plinove
1.- Virijalna jednadžba:
Za plin koji ostaje na Stalna temperatura, odnos između tlaka i volumena ili tlaka i specifičnog volumena (volumen koji zauzima svaka jedinica mase plina).
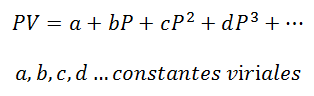
Virijalne konstante su karakteristike svakog plina, s određenim vrijednostima koje ovise o temperaturi.
Mogu se izvršiti samo izračuni tlaka i zapremine; Temperatura se prethodno određuje promatranjem postupka. Za ove izračune mijenjaju se varijable virijalne jednadžbe:
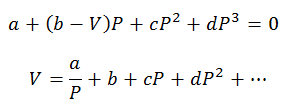
Virijalne konstante za rješavanje jednadžbi dobivene su iz specijaliziranih tablica.
2.- JednadžbaVan der Waals na:
Van der Waalsova jednadžba je još jedan izraz koji se koristi za izračunavanje svojstava stvarnog plina, a kao i Virijalova jednadžba, također zahtijeva njegove konstante:

Konstante se također traže u tablicama.
3.- JednadžbaRedli daljech-Kwong:
Ova jednadžba djeluje vrlo dobro za izračun plinova pri gotovo bilo kojoj temperaturi i prosječnim tlakovima, ali bez previsokih, poput stotina atmosfera.
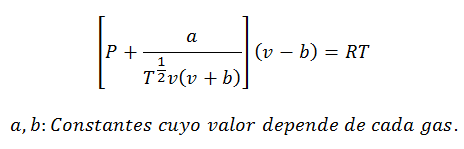
Konstante se također traže u tablicama.
Za proračun možete očistiti tlak, temperaturu i zapreminu. Ostaju odobrenja:
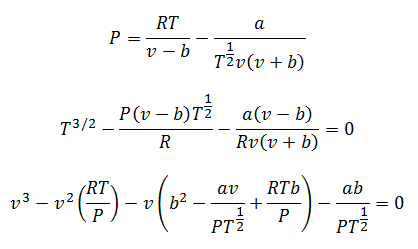
4. Berthelotova jednadžba:
Pomoću ove jednadžbe moguće je izračunati bilo koju varijablu. Samo što ima dva različita načina rada: za niske i za visoke tlakove.
Za niske tlakove:

Za visoke pritiske:
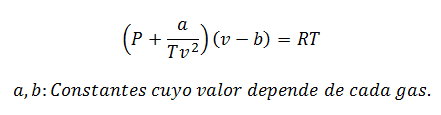
Konstante se također traže u tablicama.
5.-Jednadžba faktora kompresibilnosti
Ova je jednadžba jednostavnija varijanta Zakona o idealnom plinu; dodaje se samo faktor "z", nazvan faktor kompresibilnosti. Ovaj se faktor dobiva iz Grafikona generaliziranih faktora kompresibilnosti, ovisno o temperaturi, tlaku ili specifičnom volumenu, ovisno o tome što je dostupno.
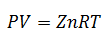
Primjeri idealnih i stvarnih plinova
Kao idealan ili stvaran lik Ovisi o uvjetima tlaka, temperature u kojoj je plin, Nije moguće uspostaviti ograničeni popis, pa je predstavljen popis plinova, koji se naravno mogu naći u idealnosti i stvarnosti.
- Amonijak
- Rashladno sredstvo R134 (DiFluoroDiCloro Ethane)
- Ugljični dioksid
- Ugljični monoksid
- Kisik
- Dušik
- Vodik
- Dušikov dioksid
- Dinitrogen trioksid
- Dinitrogen pentoksid
- Dinitrogen heptoksid
- Sumporov dioksid
- Sumporni trioksid
- Klor
- Helij
- Neon
- Argon
- Kripton
- Ksenon
- Metan
- Etan
- Propan
- Butan



