Primjer Charlesova zakona
Fizika / / July 04, 2021
Charlesov zakon o plinu ili zakon stalnog tlaka, još je jedan od zakona o plinu, proglasio Gay-Lussac, koji je objavio djelo Jacquesa Charlesa, objavljeno oko 20 godine prije.
Charlesov zakon predviđa ponašanje mase plina kada tlak ostaje konstantan, a temperatura i volumen variraju.
Charlesov zakon naveden je kako slijedi:
Pri stalnom tlaku, volumen plina je izravno proporcionalan promjeni njegove temperature.
Stalni pritisak: odnosi se na činjenicu da se pritisak koji plin vrši na stijenke spremnika neće mijenjati tijekom iskustva.
Volumen: to je zauzeti prostor koji zauzima plin, općenito se smatra spremnikom sa zidovima koji se ne deformiraju i čiji poklopac radi poput klipa.
Temperatura: To je povećanje ili gubitak topline koji plin prolazi tijekom eksperimentiranja. Ako se temperatura povećava, volumen se povećava. Ako se temperatura smanji, smanjuje se i glasnoća.
Algebarski je Charlesov zakon izražen sljedećom formulom:

Gdje:
V = zapremina plina
T = temperatura plina
k = konstanta proporcionalnosti za tu masu plina.
To znači da je za datu masu plina, pri konstantnom tlaku, odnos zapremine i temperaturne varijacije, uvijek će imati isti odnos proporcionalnosti, predstavljen konstantom k:

Dakle, nakon što se utvrdi konstanta, možemo izračunati bilo koju drugu vrijednost iz ostalih poznatih podataka:
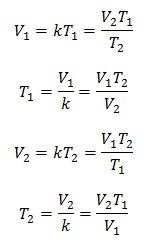
3 Primjeri Charlesova zakona primijenjenog na probleme:
Primjer 1: Izračunajte novu zapreminu ako se u posudi nalazi masa plina koja zauzima zapreminu od 1,3 litre, na temperaturi od 280 K. Izračunajte volumen pri postizanju temperature od 303 K.
V1 = 1,3 l.
T1 = 280 K
V2 = ?
T2 = 303 K
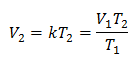
Zamjena vrijednosti:
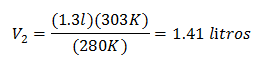
Nova zapremina na 303 K iznosi 1,41 litre.
Primjer 2. Ako imamo plin koji zauzima 2,4 litre na 10 Celzijevih stupnjeva, izračunajte konačnu temperaturu, ako na kraju zauzima 2,15 litara.
V1 = 2,4 l
T1 = 10 ° C = 283 K
V2 = 2,15 l
T2 = ?
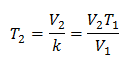
Zamjena vrijednosti:
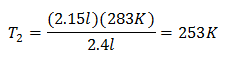
Nova temperatura je 253 K, što je jednako -20 ° C.
Primjer 3. Imamo plin čija je početna temperatura 328 K, konačni volumen 3,75 l, a konstanta omjera 0,00885.
V1 = ?
T1 = 328 K
V2 = 3,75 l
T2 = ?
k = 0,00885
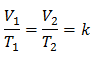
Zamjena vrijednosti:
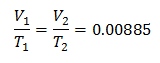
Da biste znali početni volumen:
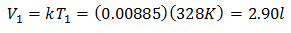
Početna količina je 2,90 l.
Da biste znali konačnu temperaturu:
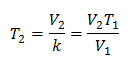
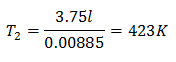
Konačna temperatura bit će 423 K, što je jednako 150 ° C.


