20 Példa savas sókra
Vegyes Cikkek / / July 04, 2021
Ban,-ben szervetlen kémia a sókat vegyületeknek nevezzük, amelyeket akkor kapunk, amikor a sav hidrogénatomjait fémes kationok helyettesítik (bár néha nem fémes kationokkal, például ammónium kationnal,4+). A konkrét esetben savas sók, a sav hidrogénjei részben szubsztituáltak, vagyis legalább egy szubsztituálatlan hidrogén marad a só részeként. Abban különböztetik meg őket semleges sókahol a sav hidrogénjei teljesen szubsztituáltak.
A kimész általában az a közötti reakció révén alakulnak ki sav és a hidroxid (bázis). Ezekben a reakciókban a bázis általában elveszíti hidroxilcsoportjait (-OH), a sav pedig elveszíti azokat. atomok hidrogén (H), amely semleges sót képez; de ha a kérdéses sav megőrzi legalább az egyik hidrogénatomját, megváltoztatva a reakció elektromos töltését, akkor savsót vagy hidrogénezett sót kapunk.
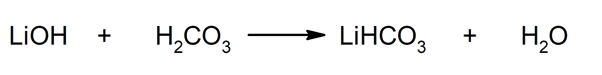
Így például lítium-hidrogén-karbonátot és vizet nyernek a lítium-hidroxid és a szénsav reakciójából:
Savsók nómenklatúrája
A savas sókat a következők szerint lehet megnevezni három típus leggyakoribb nómenklatúra:
Példák savas sókra
- Szódabikarbóna (NaHCO3). Nátrium-hidrogén-karbonátnak (IV) is nevezik, vízben oldódó fehér kristályos szilárd anyag, amely a természetben megtalálható állapotban ásványi vagy a laboratóriumban előállítható. Ez az egyik legismertebb savsó, és széles körben használják cukrászdában, farmakológiában vagy joghurtkészítésben.
- Lítium-hidrogén-karbonát (LiHCO3). Ezt a savas sót a CO megkötőjeként használták2 olyan helyzetekben, amikor az ilyen gáz nem kívánatos, mint például az észak-amerikai "Apollo" űrmissziókban.
- Kálium-dihidrogén-foszfát (KH2PO4). Kristályos, szagtalan, vízben oldódó szilárd anyag, amelyet széles körben alkalmaznak a különböző iparágakban, például étel, kelátképző, tápanyag-erősítő és asszisztens a fermentációs folyamatokban.
- Nátrium-biszulfát (NaHSO4). Ez egy kénsav semlegesítésével képződő savas só. Ipari szempontból széles körben használják fémek és tisztítószerek finomításában. Annak ellenére, hogy egyes tüskésbőrűekre nagyon mérgező, adalékanyagként használják az állateledelekben és az ékszerek gyártásában.
- Nátrium-hidrogén-szulfid (NaHS). Kezelése veszélyes vegyület, mivel erősen maró és mérgező. Súlyos égési sérüléseket és szemkárosodást okozhat, mivel éghető is.
- Kalcium-hidrogén-foszfát (CaHPO4). Évben étrend-kiegészítőként használják gabonafélék szarvasmarháknak. Szilárd vízben oldhatatlan, de kettő elfogyasztásával hidratálva kristályosodni képes molekulák vízből.
- Ammónium-hidrogén-karbonát ([NH4HCO3). Az "ammónium-hidrogén-karbonát" néven is ismert, az élelmiszeriparban élesztőként használják vegyi anyag, bár hátránya, hogy csapdába ejti az ammóniát és rossz ízt ad az ételnek, ha felhasználják felesleg. Tűzoltókészülékekben, pigmentgyártásban és a gumi habosítására is használják.
- Bari-hidrogén-karbonátvagy (Ba [HCO3]2). Ez egy savas só, amely melegítve megfordíthatja termelési reakcióját, és oldat kivételével nagyon instabil. Széles körben használják a kerámiaiparban.
- Nátrium-biszulfit (NaHSO3). Ez a só rendkívül instabil és oxigén jelenlétében nátrium-szulfáttá (Na2SW4), ezért használják az élelmiszeriparban élelmiszer-tartósítószerként és szárítószerként. Ez egy extrém redukálószer, amelyet az ember gyakran használ, a színek rögzítéséhez is.
- Kalcium-citrát (AC3[C6H5VAGY7]2). Közönségesen keserű só néven ismert, élelmiszer-tartósítószerként és táplálék-kiegészítőként használják, ha a lizin aminosavhoz kapcsolódik. Fehér, szagtalan, kristályos por.
- Monokalcium-foszfát (Ca [H2PO4]2). Színtelen szilárd anyag, amelyet kalcium-hidroxid és foszforsav reakciójával nyernek, és amelyet széles körben használnak kovászként vagy műtrágyaként a mezőgazdasági munkában.
- Dikalcium-foszfát (CaHPO4). Más néven kalcium-monohidrogén-foszfát, három különböző kristályos formája van, amelyeket adalékként használnak az élelmiszerekben, és jelen van a fogkrémekben. Ezenkívül természetes módon képződik a vesekőben és az úgynevezett „vesekőben”.
- Monomagnézium-foszfát (MgH4P2VAGY8). Fehér, kristályos és szagtalan só, részben vízben oldódik. Élelmiszerek tartósítására, savanyító szerként, savasságjavító szerként vagy szerként használják a kezelés során lisztek.
- Nátrium-diacetát (NaH [C2H3VAGY2]2). Ezt a sót ízesítő és tartósítószerként használják étkezés közben, ami megakadályozza vagy késlelteti a megjelenését gomba és mikobaktériumok, mind vákuumcsomagolt termékekben, például húskészítményekben, mind a lisztiparban.
- Kalcium-hidrogén-karbonát (Ca [HCO3]2). Ez egy hidrogénezett só, amely kalcium-karbonátból származik, amely ásványi anyagokban, például mészkőben, márványban és másokban van jelen. Ez a reakció víz és CO jelenlétével jár2, így spontán előfordulhat barlangokban és kalciumban gazdag barlangokban.
- Rubídium-sav-fluorid (RbHF). Ezt a sót hidrogén-fluorid (hidrogén és fluor) és alkálifém rubídium reakciójával nyerik. Az eredmény egy mérgező és maró vegyület, amelyet óvatosan kell kezelni.
- Monoammónium-foszfát ([NH4H2PO4). Ez egy vízoldható só, amelyet ammónia és foszforsav reakciójával állítanak elő. Általában műtrágyaként használják, mivel ez adja a talajnak a tápanyagok a növény növekedéséhez szükséges nitrogén és foszfor mennyisége. A tűzoltó készülékekben lévő ABC por része is.
- Cink-hidrogén ortoborát (Zn [HBO3]). Ez egy só, amelyet antiszeptikumként és adalékként használnak a kerámia gyártásában.
- Nátrium-foszfát (Nem2PO4). Leginkább laboratóriumokban használják "pufferként" vagy pufferoldatként, amely megakadályozza az oldat pH-jának hirtelen változását.
- Kálium-hidrogén-ftalát (KHP). „Kálium-sav-ftalátnak” is nevezik, szilárd és stabil só a közönséges levegőben, ezért gyakran használják elsődleges standardként a pH. Használható pufferanyagként is kémiai reakciók.
Kövesse:


