100 példa kémiai elemekre
Vegyes Cikkek / / November 13, 2021
A kémiai elemek olyan típusú ügyek, amelyek semmilyen eljárással, ill kémiai reakció redukálhatók vagy más egyszerűbb elemekre bonthatók. Emiatt elmondható, hogy egy elem minden ügy készítette atomok azonos és egyedi osztályúak, vagyis azonos atomszámú atomok (azonos számú proton), bár eltérő az atomtömegük. Például: kén, bór, króm, ón.
A kémiai elem első meghatározását a Lavoisier ban,-ben Traité Élémentaire de Chimie, 1789-ben. A 18. században Lavoisier az egyszerű anyagokat négy csoportra osztotta:
Periódusos rendszer az elemek
Ma ismerik egymást 118 kémiai elem. Mindegyik tulajdonságuk sokasága szerint össze van gyűjtve, osztályozva és rendszerezve egy grafikus sémában, amelyet az elemek periódusos rendszerének neveznek, amelyet eredetileg az orosz vegyész hozott létre. Dimitri Mendelejev 1869-ben. A periódusos rendszer 18 csoportból (oszlopok) és 7 periódusból (sorból) áll, amelyekben a kémiai elemek találhatók.
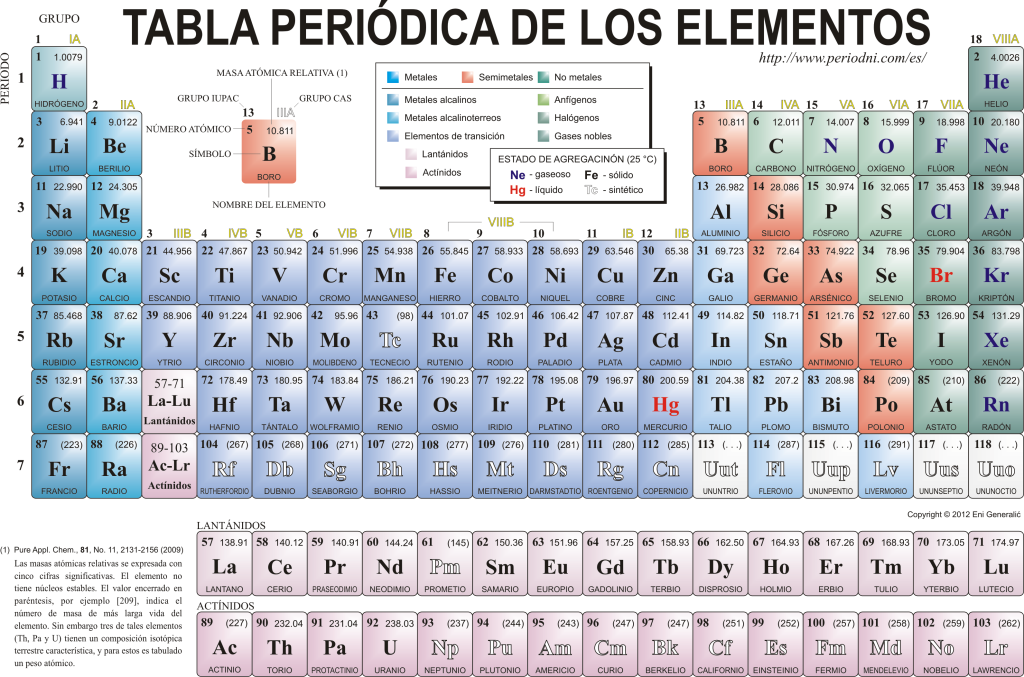
A fő csoportok amelyek ebben a táblázatban találhatók:
Az alkálifémek (1. csoport), az alkáliföldfémek (2. csoport), a szkandiumcsalád, amely magában foglalja a földet és az aktinideket (3. csoport), a titán család (4. csoport), a vanádium család (5. csoport), a króm család (6. csoport), a mangán család (7. csoport), a vas család (8. csoport), a kobalt család (csoport) 9), a nikkelcsalád (10. csoport), a rézcsalád (11. csoport), a cinkcsalád (12. csoport), földelemek (13. csoport), karbid elemek, ebben a csoportban A földi élet alapját képező szén (14. csoport), a nitrogénképző elemek (15. csoport), az amfigenetikus elemek tartalmazzák az oxigént, amely a a lélegző a élőlények (16. csoport), halogén elemek (17. csoport) és nemesgázok (18. csoport).
Ezen elemek közül sok rendelkezik stabil vagy radioaktív izotópokazaz ugyanazon kémiai elem, például a hidrogén (H), több izotóppal rendelkezhet (1H, 2H, 3H). Ez azt jelenti, hogy minden izotóp atomnak azonos számú protonja van (ami azt jelenti, hogy ugyanahhoz a kémiai elemhez tartozik) és eltérő számú neutron van.
Néhány izotóp nem stabil (radioaktív), vagyis szétesik egy bizonyos idő alatt bizonyos részecskéket (többek között neutronokat, fotonokat, alfa-részecskéket) bocsát ki, és más stabil vagy radioaktív izotópokat generál. A kémiai elemeknek olyan tulajdonságai vannak, mint a pont forró és az fúzió, elektronegativitás, sűrűség és az ionsugár többek között. Ezek a tulajdonságok azért fontosak, mert lehetővé teszik a viselkedés, reakcióképesség stb.
Hogyan vannak a periódusos rendszerben bemutatott elemek?
Minden kémiai elemre jellemző a Periódusos táblázat bizonyos szimbólummal. Először is, minden négyzet közepén annak egyetemes szimbóluma, amely egy vagy kettőből áll betűk (megegyezés szerint, ha két betű van, az elsőt nagybetűvel, a következőt kisbetűvel írjuk).
Fent és balra kis betűs betű jelenik meg atomszám, amely az elem protonmennyiségét jelzi. Az elem szimbóluma alatt a neve jelenik meg, fent pedig a bal oldalon a neve jelenik meg. atomtömeg relatív. Ezenkívül az a szín, amelyben az elem szimbóluma megjelenik, jelzi az összesítés állapotát (az egyes periódusos rendszerekben használt ábrázolásnak megfelelően).
A különböző elemek jelen vannak atomsugarak változók, és amint a magban lévő protonok száma növekszik, annál nagyobb a vonzereje, amelyet a mag kifejt az elektronokon, így az atom sugara csökken. Ha az atom sugara kicsi, akkor a felhő legkülső szintjén lévő elektronok nagyon vonzódnak a maghoz, így nem adják fel könnyen. Ennek az ellenkezője történik a nagy atomsugárral rendelkező elemekkel: könnyen feladják külső elektronjaikat.
Így az atomsugár felülről lefelé növekszik, amikor végigmegyünk a periódusos rendszer csoportjain, és balról jobbra csökken, amikor végigmegyünk a periódusokon.
Példák kémiai elemekre
| Kémiai elem | Szimbólum |
| Aktínium | Ac |
| Alumínium | Hoz |
| Americium | A.M |
| Antimon | Sb |
| Argon | Ar |
| Arzén | Ász |
| Astat | Nál nél |
| Kén | S |
| Bárium | Ba |
| Berillium | Lenni |
| Berkelium | Bk |
| Bizmut | Kettős |
| Bohrio | Bh |
| Bór | B |
| Bróm | Br |
| Kadmium | CD |
| Kalcium | AC |
| Californium | Vö |
| Szén | C |
| Cérium | EC |
| Cézium | Cs |
| Klór | Cl |
| Kobalt | Co |
| Réz | Cu |
| Króm | Kr. | |
| Kúrium | Cm |
| Darmstadio | Ds |
| Diszprózium | Dy |
| Dubnium | Db |
| Einsteinium | Ez |
| Erbium | Er |
| Scandium | Sc |
| Ón | Sn |
| Stroncium | úr |
| Europium | Eu |
| Fermium | Fm |
| Fluor | F |
| mérkőzés | P |
| Francius | Fr |
| Gadolínium | Gd |
| Gallium | Ga |
| Germánium | Ge |
| Hafnium | HF |
| Hassio | Hs |
| Hélium | Nekem van |
| Hidrogén | H |
| Vas | Hit |
| Holmium | Ho |
| indián | Ban ben |
| Jód | én |
| Iridium | Menni |
| Itterbium | Yb |
| Ittrium | Y |
| Kripton | Kr |
| Lantán | A |
| Lawrencio | Lr |
| Lítium | Li |
| Lutetium | Hétf |
| Magnézium | Mg |
| Mangán | Mn |
| Meitnerius | Mt |
| Mendelevium | Md |
| Higany | Hg |
| Molibdén | Mo |
| Neodímium | Na |
| Neon | Ne |
| Neptúnium | Np |
| Nióbium | Nb |
| Nikkel | Se |
| Nitrogén | N |
| Nobelio | Nem |
| Arany | Au |
| Ozmium | Ön |
| Oxigén | VAGY |
| Palládium | P.S |
| Ezüst | Ag |
| Platina | Pt |
| Vezet | Pb |
| Plutónium | Pu |
| Polónium | Po |
| Kálium | K |
| Praseodymium | Pr |
| Ígéret | Délután |
| Protactinium | Pa |
| Rádió | Ra |
| Radon | Rn |
| Rénium | Újra |
| Ródium | Rh |
| Rubídium | Rb |
| Ruténium | Ru |
| Rutherfordio | Rf |
| Szamárium | Ti |
| Seaborgio | Vminek |
| Szelén | Tudom |
| Szilícium | Igen |
| Nátrium | Na |
| Tallium | Tl |
| Tantál | Ta |
| Technécium | Tc |
| Tellúr | Tea |
| Terbium | Tuberkulózis |
| Titán | Ön |
| Tórium | Th |
| Túlium | Tm |
| Kopernikusz | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrium | Uut |
| Uránium | VAGY |
| Vanádium | V |
| Volfrám | W |
| Xenon | Xe |
| Cink | Zn |
| Cirkónium | Zr |

Kövesse:



