30 Példák bináris értékesítésre
Példák / / November 09, 2023
A bináris sók (semleges sók) egy fém és egy nemfém kombinálásakor jönnek létre. Vannak kémiai vegyületek csak kettőből áll kémiai elemek. Például: nátrium-klorid (NaCl) és kálium-bromid (KBr).
- Lásd még: Fémek és nemfémek
Példák bináris sókra
- Nátrium-klorid (NaCl)
- Vas(II)-klorid (FeCl2)
- Vas(III)-klorid (FeCl3)
- Kobalt(II)-szulfid (CoS)
- Kobalt(III)-szulfid (Co2Igen3)
- Ólom(II)-szulfid (PbS)
- Ólom(IV)-szulfid (PbS2)
- Kalcium-klorid (CaCl2)
- Nátrium-fluorid (NaF)
- Lítium-klorid (LiCl)
- Stroncium-klorid (SrCl2)
- Bárium-klorid (BaCl2)
- Alumínium-klorid (AlCl3)
- Magnézium-szulfid (MgS)
- Rubídium-klorid (RbCl)
- Kalcium-bromid (CaBr2)
- Kálium-szulfid (K2S)
- Magnézium-bromid (MgBr2)
- Cink-szulfid (Zn2S)
- Lítium-bromid (LiBr)
- Nikkel-klorid (NiCl2)
- Urán(III)-klorid (UCl3)
- Ezüst-bromid (AgBr)
- Ezüst-jodid (AgI)
- Kálium-bromid (KBr)
A bináris sók nómenklatúrája
A hagyományos nómenklatúra szerint a bináris sókat úgy nevezik el, hogy a nemfémes elem nevét -ide végződéssel írják le. Másrészt a fém elem nevét az oxidációs állapotának megfelelően írjuk le:
- A legalacsonyabb oxidációs állapot esetén -oso végződéssel írják. Például: vas-klorid (FeCl2), ahol a vas oxidációs állapota 2+.
- A legmagasabb oxidációs állapot esetén -ico végződéssel írják. Például: vas-klorid (FeCl3), ahol a vas oxidációs foka 3+.
A szisztematikus nómenklatúra szerint a bináris sókat úgy nevezik el, hogy a nemfémes elem nevét egy előtaggal írják, amely jelzi a sók mennyiségét. atomok ennek az elemnek a vegyületben. Ezenkívül az -uro végződést a nemfémes elem nevében helyezik el. Ezután a fém elem neve kerül elhelyezésre. Például: magnézium-diklorid (MgCl2) és vas-triklorid (FeCl3).
Stock nómenklatúrája szerint a bináris sókat úgy nevezik el, hogy a nemfémes elem nevét -ide végződéssel írják le. Ezután a fémelem neve, majd az oxidációs állapota római számmal és zárójelben olvasható. Például: vas(II)-klorid (FeCl2) és kobalt(III)-szulfid (Co2Igen3).
Bináris sók alkalmazásai
- Az élelmiszeriparban és a gyógyszeriparban hűtőközegként használják. Például: kalcium-klorid (CaCl2).
- Fémfelületek korrózió elleni kezelésére szolgálnak. Például: nátrium-fluorid (NaF).
- A páratartalom szabályozására használják a papír- és az építőiparban. Például: kalcium-klorid (CaCl2).
- Az üvegiparban használják a szennyeződések eltávolítására. Például: szilícium-tetraklorid (SiCl4).
- Főzési alapanyagként használják őket. Például: nátrium-klorid (NaCl).
A bináris sók fizikai tulajdonságai
- Magas olvadáspontjuk van, mert ezekből állnak ionos kötések.
- Oldott vagy olvadt állapotban elektromos áramot vezetnek.
- A leggyakoribb sók alacsony keménységűek.
- Nem összenyomhatók.
- A legtöbb vízben oldódik.
Hogyan állítják elő a bináris sókat?
A bináris sók a következő kémiai reakciók közül néhányan állíthatók elő:
Reakció fém és nemfém között. Például: a nátrium (Na) és a diklorid (Cl) reakciója2) nátrium-kloridot (NaCl) termel.
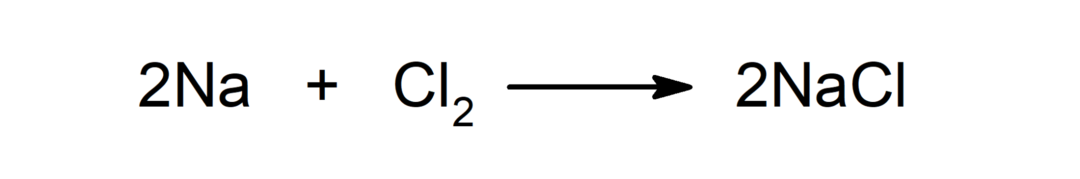
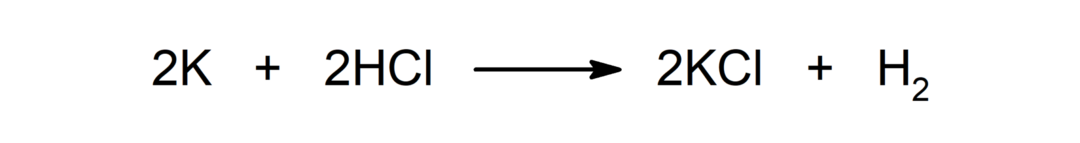
Reakció fém és sav között. Például: A kálium (K) és a sósav (HCl) reakciója kálium-kloridot (KCl) és dihidrogént (H) eredményez.2).
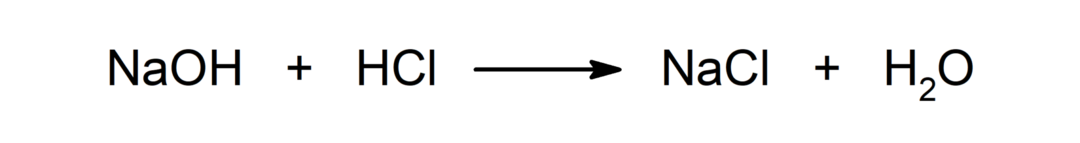
Reakció sav és bázis között. Például: A sósav (HCl) és a nátrium-hidroxid (NaOH) reakciója nátrium-kloridot (NaCl) és vizet (H) eredményez.2BÁRMELYIK).
Kövesse a következővel:
- oxisók
- semleges sók
- savas sók
Hivatkozások
- Cerón Villalba, A., Novoa Ramírez, C. S. és Alpizar Juárez, E. (2020). Nomenklatúra 1. videó: bináris sók és kémiai reakció.
- Acurio Arias, M. V. és Delgado Méndez, M. ÉS. (2022). Játékalapú tanulási útmutató „bináris vegyületekhez” a középiskolai kémiában a „Herlinda Toral” oktatási egységben (Bakalaureus szakdolgozat, Nemzeti Pedagógiai Egyetem).
- Cabrera, M. J. H. (2005). Tanulmányozás a bináris és háromkomponensű vegyületek elektronikus és szerkezeti tulajdonságainak első alapelveiből (Doktori disszertáció, University of La Laguna).



