Példa kémiai elemekre
Kémia / / July 04, 2021
Kémiai elem tiszta anyag, amely azonos típusú atomokból áll, viszont kialakult számos proton és neutron által a magban, és egy mennyiség elektronok a pályájukon. Néhány természetes úton található meg, mások egy vegyület molekuláinak kialakításával, mások pedig laboratóriumi eljárások végrehajtásával jöttek létre. Minden kémiai elem az egész univerzum anyagát alkotja, és fenntartja az emberi test létét és működését.
Minden elemnek vannak olyan jellemzői és viselkedése, amelyek megkülönböztetik és egyedivé teszik, de egyúttal hasonlóságokat mutat a megnyilvánulás elemcsoportjával, amelyek a világegyetem. Emiatt létezik a kémiai elemek periódusos táblázata, amely ezeket a hasonlóságokat tárgyalja az elemek koherens csoportosítása érdekében, és megkönnyíti azok tulajdonságainak tanulmányozását.
Egy elem atomszáma
Az atom a magban számos protont hordoz, ugyanannyi neutron kíséretében. Erre a számra atomszámnak hívjákképviseletében Z tudományos célokra és az irodalomban. Minden elem esetében ez a szám egyedi lesz. Nincs két azonos atomszámú elem. A periódusos rendszer ezen kritériumra is összpontosít a megrendelésüknél.
Egy elem szimbóluma
Alkímia idejében, amely megközelítőleg a Kr.e. 400-1000. Évet öleli fel. C., az alkimisták rögzítették kísérleteiket, amelyekhez szimbólumokat rendeltek az elemekhez. Geometriai ábrákkal készült egyszerű szimbólumok voltak, amelyek az egyes elemeket és a vizsgált transzformációkat ábrázolták.
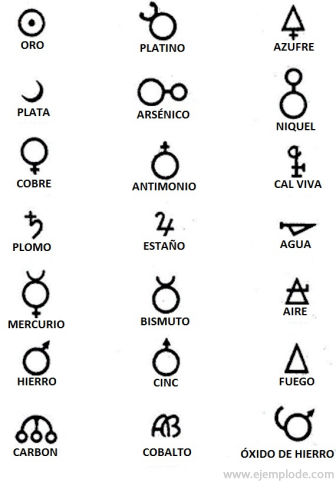
Néhány példa alkímiai szimbólumokra, az általuk képviselt elem vagy vegyület nevével.
A modern kémia korszakában az elemeket továbbra is szimbólumok, jelen esetben betűk jelentik, amelyek latinul vagy angolul utalnak a nevükre.
Például:
A nátrium szimbóluma az Na, latin nevén Nátrium
Az arany szimbóluma az Au, latin nevén Aurum
Ezüst szimbóluma az Ag, latin nevén Argentum
A réz szimbóluma az Cu, latin nevén Cuprum
Az Antimon szimbóluma az Sb, latin nevén Stibium
A Vas szimbóluma az Hit, latin nevén Ferrum
A Merkúr szimbóluma az Hg, latin nevén Hydrargyrum, ami "folyékony ezüst" -t jelent
A kálium szimbóluma az K, latin nevén Kalium
Kémiai elemcsoportok:
A kémiai elemek periódusos táblázata ezeket csoportok szerint osztályozza: A és B csoportok. Az A csoport nyolc, az Elemeket tartalmazza Lúgos, a Lúgos-földes, a Terreos, három Elements család, amelynek feje meghatározza a család nevét: Széncsalád, Nitrogén család, Kén család, a Halogének és a nemesgázok. A B csoport az összes csoportból áll Átmeneti fémek és a ritka földek, amelyek szintén két nagy család: Lanthanides Y Aktinidák.
IA csoport: alkáli elemek:
A lúgos elemek sorozatát hidrogén (H), lítium (Li), nátrium (Na), kálium (K), rubídium (Rb), cézium (Cs) és francium (Fr) alkotja. Mindegyikük olyan elektronikus konfigurációjú, hogy az utolsó héjban van egy elektron. Neve annak köszönhető, hogy amikor vízzel érintkeznek, lúgokat vagy hidroxidokat képezve reagálnak. Ez az általános viselkedés ezen elemek között. Minél nagyobb az elem atomja, annál reaktívabb, mivel egyre kisebb az az erő, amellyel a mag megtartja az elektront az utolsó héjból. Képesek ionos kötéseket kialakítani a halogénekkel. Például: A bőségesen jelenlévő ionos kötés a nátrium-klór, amely nátrium-kloridot képez NaCl.
IIA. Csoport: alkáliföld-elemek:
Ezek az elemek a következők: berillium (Be), magnézium (Mg), kalcium (Ca), stroncium (Sr), bárium (Ba) és rádium (Ra). Nem szabad természetűek; másrészt karbonátjai és szilikátjai viszonylag bőségesen léteznek. Argentin fehérek és kristályosak. Könnyen kombinálhatók oxigénnel, ha levegőnek vannak kitéve. Ez részben annak köszönhető, hogy az utolsó héjban két elektron van, amelyek egyetértenek az oxigén receptor-kapacitásával. A bárium a csoport legaktívabb eleme, és a kalciummal együtt ők a legtöbb ipari felhasználásúak a csoportban.
IIIA. Csoport: Földi elemek:
A IIIA. Csoport a bór (B), az alumínium (Al), a gallium (Ga), az indium (In) és a tallium (Tl) elemeket tartalmazza. A bór nem fémes elem, az alumínium amfoter (amfifrotikus), vagyis képes savként és bázisként működni; a másik három pedig fémes elem. Az utolsó héjban három elektron van, amelyek +3 vegyértéket generálnak, bár néha a gallium egyes vegyületeiben +1 és +2 vegyértékkel hat. A bór az egyetlen elem ebben a sorozatban, amely hidrideket képez. A bór és az alumínium karbidokat képez.
IVA. Csoport: Széncsalád:
Az IVA csoport reprezentatív elemei: szén (C), szilícium (Si), germánium (Ge), ón (Sn) és ólom (Pb). Az első kettő alapvetően nem fémes tulajdonságokkal rendelkezik, de a germánium, az ón és az ólom fémes, és annál nagyobb az atomszámuk. A szilícium kivételével minden elem vegyértéke +4 és +2.
A szén és a szilícium olyan vegyületeket képez, amelyekben az elemek atomjait megosztott elektronpárok kötik össze. A szén a szerves vegyületek lényege, mivel összekapcsolódik a hidrogén, oxigén, nitrogén, kén és néha szilícium atomjaival.
A szilíciumot és a germániumot elektronikai alkatrészek gyártására használják, mivel azoknak az a tulajdonsága, hogy félvezetőként viselkednek.
VA csoport: nitrogéncsalád:
A VA csoport a nitrogén (N), a foszfor (P), az arzén (As), az antimon (Sb) és a bizmut (Bi) elemeket tartalmazza. A nitrogén és a foszfor nem fémes, az arzén és az antimon metalloidok, a bizmut pedig fém. Ezeket az elemeket hidridek képződése jellemzi, amelyek közül a legkevésbé mérgező az ammónia-NH3. A nitrogén salétromsavat képez3, sósavval együtt az Agua Regia-ban, amely nemesfémek, például arany és ezüst oldására képes keverék.
A nitrogén részt vesz a szerves vegyületek két nagy csoportjában, az úgynevezett aminokban és amidokban, amelyek az ammónia NH származékainak tekinthetők.3, hidrogén helyettesítésével szénhidrogén lánccal.
VIA Csoport: Oxigéncsalád:
Oxigén (O), Kén (S), Szelén (Se), Tellúr (Te) és Polónium (Po) elemekből áll. Az oxigén a legaktívabb, és képes könnyen kovalens kötéseket kialakítani. Fémekkel érintkezve magas páratartalmú környezetben oxidokat képez. Ez egy ózon nevű rezonáns molekulát képez, amely megvédi a bolygót az UV sugárzástól.
VIIA. Csoport: Halogének:
A neve jelentése "Értékesítési Formers". A csoportot a Fluor (F), a klór (Cl), a bróm (Br), a jód (I) és az Astate (At) elemek alkotják. Az utolsó héjban hét elektron van, ami lehetővé teszi számukra, hogy egy elektron receptorai legyenek. Ez a minőség összekapcsolja őket az IA csoport elemeivel, bináris sókat képezve. A fluort a teljes periódusos rendszer legnagyobb elektronegativitása jellemzi, értéke 4,0, párja cézium, 0,7-es elektronegativitással. Ez a tulajdonság lehetővé teszi, hogy legyen ereje vonzani más atomokat, és elsőbbséget biztosítson a kötés kialakításához ők.
VIIIA. Csoport: Nemesgázok:
Inertgáz-csoportnak is nevezik, és a Hélium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) és Radon (Ra) elemekből áll. Ezek azok az elemek, amelyek teljes elektronikus konfigurációval rendelkeznek, így a szokásos körülmények között nem képesek reagálni. Főleg világító kereskedelmi táblákhoz használják, amelyek látható fényt bocsátanak ki, amikor elektromos áram történik rájuk.
B csoport: Átmeneti fémek:
Tíz, egyenként három elemből álló csoportban az átmenetifémek vannak csoportosítva. Ide tartoznak a legjobb elektromos vezetők: Ezüst (Ag), Réz (Cu), Arany (Au); a legjobb szerkezeti elemek a városépítéshez és a mérnöki munkához; Vas (Fe), titán (Ti), alumínium (Al), cirkónium (Zr), volfrám (W); a legjobb katalizátorkomponensek: nikkel (Ni), vanádium (V), platina (Pt); és a bevonat fő összetevői: kadmium (Cd), króm (Cr), cink (Zn). Általában +1 és +3 közötti értékeket kezelnek, de a Chromiumhoz hasonló elemek a +2, +3, +6 értékeket kezelik.
Ritkaföldfémek: lantanidok és aktinidek:
Ritka földeknek hívják őket, mivel a bolygón kevés. Két csoportból állnak: Lanthanides és Actinides. A periódusos rendszer két külön sorában találhatók. Általában +3 vegyértékkel dolgoznak, és általában hidroxidokat képeznek. A legfontosabb elem közülük a cérium, amelyet piroforos ötvözetek (ötvözet ötvözet) előállításához használnak Mischmetal, az öngyújtók köveihez), világítógáz tömlőkben és speciális üvegek gyártásához, amelyek elnyelik az ultraibolya sugarakat és a hősugárzást.
A legerősebb radioaktív elemek, mint például az urán (U) és a plutónium (Pu), e csoportok részét képezik. amelyek instabilitásuk miatt energiát szabadítanak fel és szétesnek, elveszítve az alfa részecskéket (a magokat) Hélium). Később kevésbé instabil elemekké válnak a radioaktív sorozat szerint.


