A kémiai kötések típusai
Kémia / / July 04, 2021
Amikor két vagy több atom alkot egy molekulát, akkor az a segítségével egyesülnek az elektronok közötti csomópont utolsó rétegei közül a legfelületesebb. Ezt az uniót hívják Kémiai kötés. A kémiai kötés kialakulásához az atomoknak meg kell lenniük hiányos oktett, vagyis kevesebb, mint nyolc elektron van az utolsó héjban, ez az a szám, amely kémiai stabilitást biztosít számukra.
Háromféle kémiai kötés létezik:
- Ion kötések
- Kovalens kötések
- Fém linkek
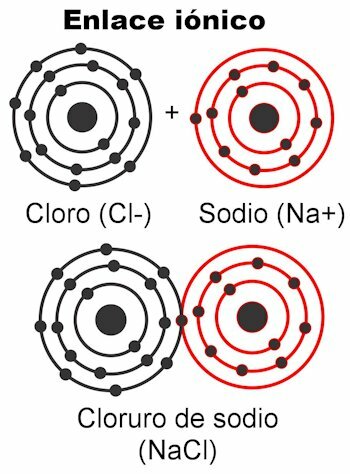
Ion kötések
Az ionos kötések azok, amelyekben a vegyérték elektronok elektrosztatikus erők vonzzák. Azok az atomok, amelyek 1–4 vegyértékű elektronnal rendelkeznek, el tudják juttatni őket a kötés kialakításához; Ez pozitív töltést ad, mert megszabadulna a negatív töltetektől. Másrészt az atom (ok), amelyek 5-7 vegyértékű elektronnal rendelkeznek, képesek befogadni a 8 eléréséhez szükséges atomokat.
Ez negatív töltést ad nekik, mert felveszik az elektronokat, amelyek negatívak. Az a tény, hogy az elektronok befoghatók vagy leadhatók megadja az atomoknak az elektromos töltést
. Coulomb törvénye szerint a töltések mindkét atomnál kialakultak erővel fogják vonzani egymást, amely a fent említett elektrosztatika. A negatív töltések pozitív töltéseket vonzanak, és fordítva. Az ellentétes díjak vonzzák. Amint ez az erő összeköti őket, kialakul a molekula.Az ionos kötések többnyire előfordulnak a fém- és nemfém atomok között. A fémek feladják elektronjaikat, és mindig pozitív töltést hordoznak, kationként vesznek részt (+). A nemfémek elektron receptorok, és általában negatív töltést hordoznak anionok (-), de az is előfordul, hogy pozitív töltést hordoznak, ez akkor, amikor töltött atomcsoportokat alkotnak hívott gyökök, ammónium-NH-ként4+, karbonát CO3-2, foszfát PO4-3.
Az ionos kötésekkel képződő kémiai vegyületek között vannak:
- Bináris sók
- Oxisales
Amikor ezeket az anyagokat vízben oldják elhatárolódnaknevezetesen különítsék el elektromos töltésükbe és ezek diszpergálódnak a vízben a H hidrogénionokkal együtt+ és hidroxil (OH-), amelyek vizet képeznek. A képződő keverék az úgynevezett megoldás elektrolit.
- Olvasson tovább: Ionos kötés
Kovalens kötések
A kovalens kötések azok, amelyekben az elektronok megoszlanak anélkül, hogy leválasztanák őket az atomról, vagyis elektromos töltések képződése nélkül. Az atomokat a közelség tartja össze, és használják azt az erőt, amellyel a mag vonzza az elektronokat. A kötés létrejötte után az atomok két vagy több magja vonzza a közös elektronokat, ezáltal teljesítve az oktett szabályt és stabilá téve a molekulát.
A kovalens kötésnek számos formája létezik, és ezek a következők:
- Kovalens kötés
- Koordinálja a kovalens kötést
- Poláris kovalens kötés
- Nempoláris kovalens kötés
A kovalens kötés Pont olyan, mint az elején leírt. A részt vevő atomok megosztják az elektronokat, így mindegyiknek megvan a teljes oktettje. Itt nincsenek elektromos töltések, mert elektronok nem hullanak ki, csak megosztják őket.
Ban,-ben koordinálja a kovalens kötést csak egy atom járul hozzá a kötéshez szükséges összes elektronhoz. A másik atom egyszerűen összekapcsolódik, és ezeket az elektronokat sajátjának veszi. A molekula így alakul ki. Ez a helyzet például a H kénsavval2SW4 amelyben a kén két elektronpáron osztozik oxigénatomokkal.
Ban,-ben poláris kovalens kötés, az atomok közötti erők a molekula egyik oldalára dőlnek. Ez amikor különböző típusú atomok vannak a molekulában. Ezt az erőt Debye egységekben mérjük, és minél nagyobb az értéke a molekula egyik oldalán, annál polárosabb lesz. Ez azt jelenti, hogy a struktúrában pólusok képződnek, és ezért kapják ezt a nevet. Erői aszimmetrikusak.
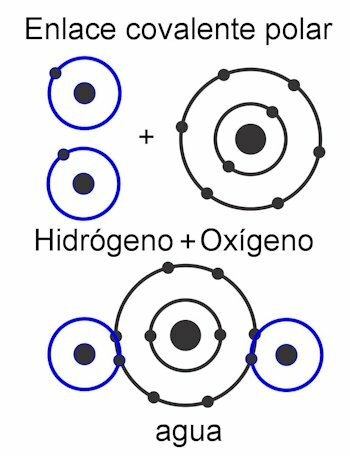
Ban,-ben nempoláris kovalens kötés, az atomok közötti erők az egész molekulában egyenletesek, ezért szerkezetében nem képződnek pólusok. Ez egyetlen egységként működik, és ezért nagyon nehéz, szinte lehetetlen megosztani a terheléseket. Ez vízben oldhatatlanná teszi. Ilyen vegyületek például alkánok, amelyek egyenlő erővel bírnak a molekulában. Erői szimmetrikusak.

- Olvasson tovább: Kovalens kötés
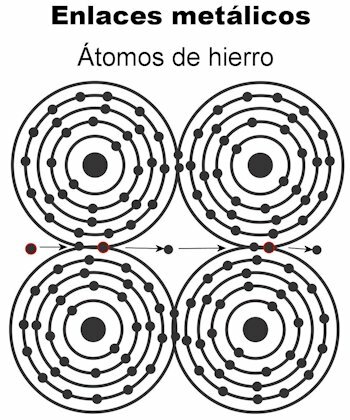
Fémes kötés
A fém atomjait fémes kötések segítségével tartják össze. Ebben a típusú kötésben az összes atom elektronja vonzódik, hogy szilárd maradjon egy kristályrács. A kristályrács kötéseiben az összes elektron kereszteződik és elrendezve, hogy elektromos áramot és hőt szállítson amikor továbbítják nekik. Az átmenetifémekben ez a fémkötések szerkezete figyelemre méltóbb, mivel atomjaik nagyobbak.
Példák az ionos kötésre
Néhány ionos kötéssel rendelkező anyag:
- NaCl-nátrium-klorid. Ionjai Na+ és Cl-.
- Kálium-klorid KCl. Ionjai K+ és Cl-.
- Kalcium-klorid CaCl2. Ionjai Ca+2 és Cl-.
- Magnézium-klorid MgCl2. Ionjai Mg+2 és Cl-.
- Stroncium-klorid SrCl2. Ionjai Sr+2 és Cl-.
- Bárium-klorid BaCl2. Ionjai Ba+2 és Cl-.
- Alumínium-klorid AlCl3. Ionjai Al+3 és Cl-.
- Na nátrium-szulfát2SW4. Ionjai Na+ És aztán4-2.
- Kálium-K-szulfát2SW4. Ionjai K+ És aztán4-2.
- Kalcium-szulfát CaSO4. Ionjai Ca+2 És aztán4-2.
- Kalcium-szulfát MgSO4. Ionjai Mg+2 És aztán4-2.
- Stroncium-szulfát SrSO4. Ionjai Sr+2 És aztán4-2.
- Bárium-szulfát BaSO4. Ionjai Ba+2 És aztán4-2.
- Na-nátrium-foszfát3PO4. Ionjai Na+ és PO4-3.
- Kálium-K-foszfát3PO4. Ionjai K+ és PO4-3.
- Magnézium-foszfát Mg3(PO4)2. Ionjai Mg+2 és PO4-3.
- Kalcium-foszfát Ca3(PO4)2. Ionjai Ca+2 és PO4-3.
- Alumínium-foszfát AlPO4. Ionjai Al+3 és PO4-3.
- Vas-foszfát Fe3(PO4)2. Ionjai Fe+2 és PO4-3.
- Vas-foszfát FePO4. Ionjai Fe+3 és PO4-3.
Példák a kovalens kötésre
Néhány olyan anyag, amely kovalens kötéseket mutat:
- Metán CH4.
- Etán C2H6.
- C propán3H8.
- Bután C4H10.
- Pentán C5H12.
- Hexán C6H14.
- Heptán C7H16.
- Oktán C8H18.
- Propilén-CH2= CH2–CH3.
- Acetilén C2H2.
- Metil-alkohol CH3
- Etil-alkohol C2H5
- Propil-alkohol C3H7
- Izopropil-alkohol CH3CH (OH) CH3.
- 2-propanon vagy aceton CH3Autó3.
- Formaldehid HCHO.
- Acetaldehid CH3
- Propionaldehid CH3CH2
- Butiraldehid CH3CH2CH2
- Hangyasav HCOOH.
Példák fémes kötésre
Néhány fémkötést mutató anyag:
- Cink Zn
- Kadmium Cd
- Réz Cu
- Ezüst Ag
- Arany Au
- Nickel Ni
- Palladium Pd
- Platinum Pt
- Cobalt Co
- Ródium Rh
- Iridium Go
- Vas Fe
- Ruthenium Ru
- Osmium Os
- Mangán Mn
- Króm kr
- Molibdén Mo
- Wolfram W
- Vanádium V.
- Zrconium Zr
Kövesse:
- Atomok
- Ion
- Fémek
- Nincs fém
- Alkanes
- Megoldások



