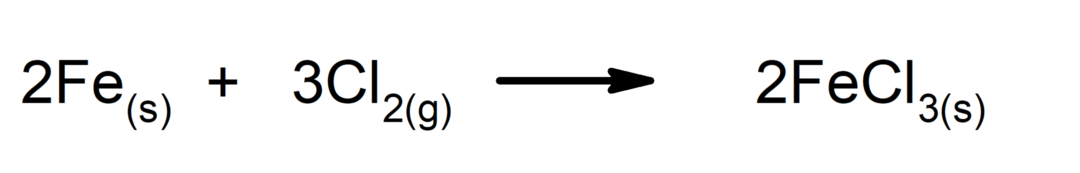
Példa kémiai fokozatra
Kémia / / July 04, 2021
Az általános kémia szerint a kémiai fokozat a Az anyag oldat koncentrációjának megismerésére használt elemzési módszer, apránként összekeverjük egy másik ismert koncentrációjú oldattal, amellyel kémiai reakciót fog végezni.
A kémiai titrálás a kvantitatív elemzés egyik módszere, ami azt jelenti egy bizonyos anyag mennyiségének ismeretére összpontosít a problémamegoldás. Ezeknek az adatoknak a megszerzésére hívják ezt a módszert Értékelésnek is.
A kémiai titráláson és a titráláson kívül annak összes alkalmazását együttesen hívjuk meg Volumetria, amely arra a tényre utal, hogy az elemzéshez két folyékony oldat kölcsönhatásba lép egymással a megfelelő koncentrációk, az egyik ismert, a másik ismeretlen, a ismeretlen.
Nak nek Az ismeretlen koncentráció mintáját Analyte-nak hívjuk, és a megoldás, amely segít megismerni ezeket az információkat Átlagos megoldás.
Kémiai fokozat eljárása
Egy példát használunk a titrálási eljárás jobb megértéséhez. Meg kell határozni a nátrium-hidroxidot (NaOH) tartalmazó oldat mintájának koncentrációját.
1.- Elindításához elengedhetetlen tudja, melyik komponenst kell mérni. A példában meg kell határozni a mintában a nátrium-hidroxid (NaOH) koncentrációját.
2.- Egy ismert koncentrációjú anyagot választunk hogy reagáljon a mintával. Olyan anyagnak kell lennie, amely képes jó sztöchiometrikus arányban reagálni. Általában, mivel a nátrium-hidroxid bázis, savat használnak kémiai reakció során. Ebben a példában sósavat (HCl) használunk, amely 1: 1 arányban reagál a hidroxiddal.
3.- A mintát előkészítjük. A titrálásokra specifikus Erlenmeyer-lombikba bizonyos mennyiségű mintát adunk; néha 10 milliliter, máskor 25 milliliter. Általában olyan állapotban adják hozzá, bár néha desztillált vízzel hígítják. De mindig igaz, hogy 10 vagy 25 milliliteresek. Elengedhetetlen a munka mennyiségének ismerete.
4.- A reakció indikátorát választjuk. A reakció indikátor olyan vegyi anyag, amelyet a titrálás megkezdése előtt adnak a mintához. A reakció indikátora kémiailag nem érintett. Amit tesz, színt ad a mintának, és amikor a reakció véget ér, megváltoztatja a színét. Ez a funkciója: a szín megváltoztatása, jelezve, hogy a reakció véget ért. Így tudni fogja, hogy mennyi sósavat használtak fel az összes nátrium-hidroxiddal való reakcióra. Az indikátort a reakció és a kezelendő pH függvényében választjuk meg. Ebben az esetben, a reakció sav-bázis semlegesítésés a kezelendő pH értéke 3 és 5 között van, így a példa szempontjából a legalkalmasabb a metil-narancs.
5.- Készítsen egy burettát az ismert koncentráció oldatával, amely például a sósav. A büretta egy üvegcső, amelynek skálája milliliterben van, és amelybe az ismert koncentrációjú anyagot ki kell üríteni. A másik végén áramlásszabályozó szeleppel rendelkezik, amely olyan tömített, hogy az elemző manipulálhassa. és olyan áramlást érjen el, amely magabiztosságot ad a leállításhoz, amikor az indikátor azt mutatja, hogy a reakció megtörtént befejezett.
6.- A megtöltött bürettát egy univerzális tartóra helyezzük a megfelelő tartozékokkal annak megtartásához. A levegőben, a tartó alján megkezdődik a titrálás, apránként kinyitva a büretta csapot, hogy cseppenként történik semlegesítés. Azzal a kézzel, amely a minta Erlenmeyer-lombikját tartja, a reakciót megrázzák, miközben a burétából származó sugár pontosan ott érkezik.
7.- Ha az indikátor színét megváltoztatja, a buret csap elzáródik. A skálán látni fogják, hogy hány milliliter Sósav semlegesítés céljából hozzáadtuk a mintához. Ez az adat számít számunkra.
8.- A kapott adatokkal a számítások a koncentráció megismerésére nátrium-hidroxidból, amit tudnia kell.
Azok az egységek, amelyekben a koncentrációt kezelik
A koncentráció az alkalmazott térfogattól függően több egységben mérhető, amely kényelmes a számítások során:
Molaritás (mol / liter): Utal valamire az oldott anyag moljainak száma, vagyis annak az anyagnak, amellyel dolgozik, minden oldat literért. Az anyajegyek értéke megegyezik a grammoknak az anyag molekulatömegével elosztott értékével. A példában a nátrium-hidroxid molekulatömege 40 g / mol.
Normálitás (egyenérték / liter): Ez a száma egyenértékű oldott anyag minden liter oldatban. A szóban forgó anyag egyenértékeit úgy számoljuk ki, hogy a grammokat elosztjuk az ekvivalens tömeggel. Az ekvivalens tömeg kiszámítása ugyanazon anyag molekulatömegének és aktív vegyértékének hányadosa. A példában a nátrium-hidroxid (NaOH) ekvivalens tömegét 40 g / mol molekulatömeggel kapjuk meg, és ezt elosztjuk 1-vel, amely az a vegyérték, amellyel az OH kémiailag hat-.
Gramm literenként: Ez az anyag literenként számított grammja. Ezeket az egységeket nem használják gyakran, mivel a titrálás során kémiai reakció történik, és a kémiai reakciókat csak a vakondok kezelése érti és méri.
Vannak más egységei is Koncentráció molaritásként (mol / kg oldószer), de a titrálás céljából, amelyben csak köteteket használnak, a molalitás haszontalan a számítások elvégzésénél.
Példák kémiai fokozatra
A titrálás vagy a volumetria nagyon specifikus alkalmazásokkal rendelkezik, mivel az ilyen típusú elemzésnek alávethető vegyi anyagokat számba vesszük. A létezőket idézik.
Sav-bázis térfogat: A legegyszerűbb, mivel kémiai reakcióból áll egy sav és egy bázis között. Az ebben a mennyiségben használt indikátorok a titrálás során kezelt pH-értéktől függően változnak. A metil-narancs és a fenolftalein a fő.

Komplexometria: Ez a térfogat egy komplexképző szer standard oldatát használja, amely egy molekula, amely csapdába ejti az analit bizonyos elemét annak izolálásához és mennyiségének elemzéséhez. A legfontosabb standard megoldás az etilén-diamin-tetraecetsav vagy az EDTA.

Redox térfogat: A benne lejátszódó kémiai reakciók jellemzik, amelyek oxidációs és redukciós reakciók. Példa erre a vas (Fe) meghatározása Cr-dikromát-ionnal2VAGY7-2.

Argentometria: Kizárólag a kloridok (Cl-) mintában egy ezüst-nitrát standard oldat (AgNO3).

Ne felejtsük el, hogy megjegyzéseket.