A halogének jellemzői
Kémia / / July 04, 2021
A halogének azok a kémiai elemek, amelyek a periódusos rendszer VIIA vagy 17. csoportjában találhatók. A fluort, a klórt, a brómot, a jódot és az asztátot tartalmazó elemekből áll.
A halogén név a görögből származik és "sók előállítóját" jelenti, mivel ezek az elemek nátriummal alkotnak sókat, amelyek hasonló tulajdonságokkal bírnak, mint a közönséges só.
A halogének közös jellemzői:
Ezek egyértékű elemek, vagyis csak egy vegyérték számuk van. Halogénekben a vegyérték értéke -1.
A hidrogén iránti affinitásuk az úgynevezett hidrogénsavakat képezi.
Kevés affinitásuk van az oxigénhez, ezért nem oxidokat képeznek, hanem nagyon magas hőmérsékleten.
Fémekkel egyesülve halogén sókat képeznek.
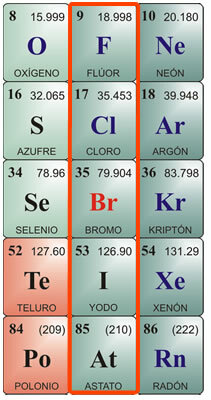
A halogének egyedi jellemzői:
Fluor jellemzői:
Kémiai szimbólum F. 9. atomszám, atomtömeg 19. A tiszta állapotú fluor sárga gáz, olvadáspontja -223 ° C és forráspontja -187 ° C. Nem létezik szabad természetben, ezért el kell különíteni. Először 1886-ban izolálták. Fizikai jellemzői: Zöldessárga gáz, Nagyon maró és irritáló, éles szagú, mérgező az emberekre és az állatokra. Nehéz cseppfolyósítani. Kémiai jellemzők: Kombinálódik hidrogénnel, nagyon alacsony hőmérsékleten is, exoterm reakcióval. Fémekkel kombinálódik, sókat képez. Bontja a sósavat, klórt termel, és vizet bont, oxigént szabadítva fel. Hidrogén iránti affinitása miatt szerves anyagokból veszi, karbonizálja őket. Az egyik fő vegyülete a fluorsav, amelyet csak platina- vagy viaszedényekben lehet tárolni, mivel üvegben megtámadja a szilícium-dioxidot. Nagyon illékony és nagyon maró hatású. Fémekkel kombinálva fluoridokat termel.
Klór jellemzői:
Cl. Kémiai szimbólum 17. atomszám, atomtömeg 35,5. Olvadáspont - 102 ° C, forráspont -37 ° C. A klórt 1774-ben fedezték fel, és 1811-ben izolálták. Fizikai tulajdonságok: Ez egy zöldessárga gáz, amely nem létezik szabad természetben, mivel általában sókban kombinálva található meg. Fojtogató és mérgező szaga van. Kémiai tulajdonságok: A klór nagyon rokon a hidrogénnel, és exoterm reakcióban sósavat eredményez. A sósavat, amelyet muriatinsavnak vagy füstölgő sónak is neveznek, már az ókori Róma óta ismerték. A vulkánokban gáz halmazállapotban találták, és a vulkánok közelében lévő egyes folyók vízében oldották fel. Nagyon maró hatású a bőrre és lenyelve mérgező. A gyomor emésztés céljából termeli. További fontos klórvegyületek a hipokloritok, különösen a nátrium-hipoklorit, amelyet vízben oldva vízfehérítőként, fertőtlenítőszerként és sterilizálószerként alkalmaznak. Semlegesíti a savakat.
Bróm jellemzői:
Kémiai szimbólum Br. 35-ös atomszám, atomtömeg 79,9. Olvadáspont -7,3 ° C, forráspont 58,8 ° C. A természetben nem található meg szabadon, de fémekkel kombinálva bromidokat képez. Elektrolízissel izolálják. Fizikai tulajdonságok: Sötétvörös folyadék, irritáló szaggal; szobahőmérsékleten irritáló sűrű narancsvörös gőzt bocsát ki, köhögést és könnyezést okozva; Mérgező. Oldódik éterben vagy kloroformban, és alig oldódik vízben. Kémiai tulajdonságok: A bróm megtámadja a szerves anyagokat; élőlényekben korrodálja a bőrt és nehezen gyógyuló fekélyeket okoz. Fő felhasználása bromidokat képző fémekkel kombinálva, amelyeket ipari célokra használnak, mint például az ezüst-bromidot, amelyet korábban a fényképészetben használtak. Alacsony koncentrációban antiszeptikumokként is használják őket. Hidrogénnel kombinálva hidrogén-bromidot eredményez, amely színtelen, szúrós szagú és ízű gáz, amelyet főleg fémek megtámadására és bromidok előállítására használnak.
A Jód:
I. kémiai szimbólum 53. atomszám, atomtömeg 126,9. Olvadáspont 113 ° C; forráspont 184 ° C Nem létezik szabad természetben. Jodidként található meg a hínárfenékben, és egyes ételek ásványi anyagainak részeként, például vízitorma, tőkehalolaj és kagyló. Fizikai tulajdonságok: A jód szilárd, kristályos test, feketésszürke színű, fémes fényű, erős és kellemetlen szagú. Gyengén oldódik vízben és nagyon oldódik alkoholban. Kémiai tulajdonságok: Jodidokat képező fémekkel kombinálódik; metalloidokkal, például kénnel és foszforral is. Nagyobb affinitása van az oxigénhez, mint a többi halogén. Ammóniával kombinálva nitrogén-jodidot képez, amely robbanásveszélyes gáz. Hidrogénnel kombinálva hidrogén-jodidot állít elő, színtelen, csípős szagú és ízű gázt, amely levegő jelenlétében füstöl. Feloldódik vízben, és fény és hő hatására lebomlik. Ha a savmolekula oxigént tartalmaz, akkor jósav keletkezik, amely kristályos szilárd anyag, oxidáló tulajdonságokkal. A jódot alkoholtartalmú oldatban használják fertőtlenítő és fertőtlenítő szerként.
A Astatus:
A szimbólum. 85-ös atomszám, 210-es atomtömeg. Nem létezik szabad természetben. Olvadáspont: 254 ° C; forráspont 962 ° C Az atsztint először az 1940-es években szintetizálták, mivel ez egy olyan elem, amely felszabadul a bizmutatomok alfasugarak általi lebontásából. Ez egy nagyon rövid élettartamú radioaktív elem; a leghosszabb ideig tartó izotóp az At210, maximális élettartama körülbelül 8 óra. Kémiai tulajdonságait nagyon hasonlónak tekintik a jódéhoz; fizikailag a fémekéhez hasonló megjelenésű és tulajdonságokkal bírhat. Annak ellenére, hogy radioaktív elem, nem jelent veszélyt az egészségre, mivel a természetben általában nem található meg. A laboratóriumban csak néhány alkalmazás van az atomok címkézésére a szubatomi anyag tanulmányozása során.