Fémes kötés példa
Kémia / / July 04, 2021
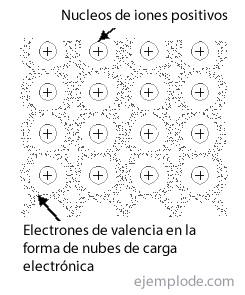
A Fémes link az a mód, ahogyan a fém atomjai képesek találkozni a kristályos szerkezet, stabil, a elektronjainak felhőiés anélkül, hogy az ionos vagy kovalens kötések kizárólagosan tiszta anyagként nyilvánulnának meg. Meg van nevezve Háló a fémes linkek csoportjához vagy elrendezéséhez.
A legtöbb fém háromféle elrendezésben kristályosodik: Testközpontú köbös hálózatok, Arccentrikus köbös hálózatok Y Kompakt hatszögletű hálózatok.
A testközpontú, a fém minden atomját 14 szomszéd veszi körül, a többiekben is kettő megmaradt 12-ig. Ha megpróbálja kezelni az ilyen struktúrák kötését, akkor azonnal megtalálja az elektronelégtelenség problémáját. Tehát egyetlen vegyértékű elektront és 14 közeli szomszédot tartalmazó lítium esetében meg kell magyarázni, hogy ez az elem ilyen nagy számú atom vesz körül, és mégis elég stabil kristályt generál ahhoz, hogy olvadáspontja legyen 186 ° C Ugyanez történik más fémekkel is.
A svájci fizikus Felix bloch 1928-ban kvantummechanikai elméletet javasolt az atomok fémes kristályokban való megkötésének magyarázatára. Ebben
Zenekarelmélet minden atom, amely teljes mértékben kitöltött energiaszinten jelen van egy atomban, lényegében figyelembe vehető található, vagyis azokhoz az atomokhoz kötődik, amelyekhez kapcsolódnak. Másrészt a vegyérték elektronokat figyelembe vesszük a kitöltetlen energiaszintekben ingyenes, és olyan potenciális mezőben mozognak, amely kiterjed a kristályban jelen lévő összes atomra.A atompályák ezen szabad elektronok egy atomban átfedés másokéval, hogy származzanak áthelyezett molekuláris pályák amelyek kötést hoznak létre az összes jelenlévő atom között, és amelyek a nevükön ismertek A vezetői pályák.
A energiaszintek elektronok izolált atomokban vannak diszkrét és általában jól elosztva. De más atomok jelenléte a kristályban hatással van ezekre a szintekre azáltal, hogy minden szintet a-vá alakít szint sáv amelyek száma megegyezik a szerkezeti összességben jelenlévő atomok számával. Ha ez a szám nagy, akkor minden egyes szint gyakorlatilag a folyamatos sáv. Akkor is, ha az eredeti szintek és a fém atomjai között nagy a tér, akkor a korai elektronikus szintekről származó sávok el vannak választva egymástól mert energiahiányok figyelemre méltó. Ha a szint és a távolság kicsi, a sávok igen kereszt és átfedés minden egyes.
Ez az elmélet az alábbiakban ismerteti az adott fém elektronikus szerkezetét. A szilárd fém tekinthető elektroncsíkok által elválasztva egymástól energiahiányok. Ezen túlmenően ezek a sávok néha teljesen meg vannak töltve lokalizált elektronokkal, vagy részben szabad elektronokkal vannak feltöltve, amelyek molekuláris pályái a kristály összes atomjára kiterjednek.