Contoh Kimia Organik
Kimia / / July 04, 2021
Itu Kimia organik Ini adalah bagian dari Kimia Umum yang bertanggung jawab atas studi dan klasifikasi fungsional senyawa kimia yang unsur strukturalnya adalah Karbon, hadir dalam kelimpahan di benda hidup; Ini menciptakan alam semesta Kimia Anorganik yang sangat berbeda, didedikasikan untuk senyawa kimia yang diklasifikasikan sebagai mineral.
Atom Karbon memiliki empat elektron di kulit terakhir konfigurasi elektronnya. Karakteristik ini, bersama dengan jari-jari atomnya, memungkinkannya untuk bergabung dengan ikatan kovalen dengan yang lain atom dari unsur yang sama, dalam banyak rantai, membentuk keragaman besar senyawa kimia stabil.
Anda dapat memeriksa Ikatan kovalen.
Senyawa kimia tersebut, selain atom Karbon yang memberi mereka struktur primordialnya, mengandung atom Hidrogen sebagai pelengkap utama untuk valensi Karbon. Selain itu, dalam keanekaragaman senyawa ini, ada yang dengan intervensi atom oksigen, Nitrogen, Halogen, Sulfur dan bahkan Fosfor, unsur alkali dan alkali tanah dan logam dari transisi. Tergantung pada siapa yang terlibat dalam molekul, itu akan menjadi sifat fisik dan kimia dari zat akhir.
Itu senyawa organik hadir di seluruh benda hidup; mempromosikan dan mempertahankan semua fungsi biologis, tidak seperti zat anorganik atau mineral, yang telah digunakan oleh manusia untuk tujuan komersial, untuk eksperimen atau untuk memenuhi tugas rumah tangga tertentu.
Sejarah Kimia Organik
Sebelum tahun 1828, perbedaan telah dibuat antara Kimia Organik dan Kimia Anorganik. Bahan organik dikaitkan dengan penciptaan melalui a "kekuatan vital", dan anorganik dengan yang tak hidup, dengan mineral. Mengingat konsepsi ini, orang tidak dapat mengharapkan untuk memperoleh senyawa organik dari bahan anorganik di laboratorium.
Namun, pada tahun 1828 Friedrich Wöhler (1800-1882) berhasil menyiapkan zat organik, Urea CO (NH2)2, produk penting metabolisme hewan, dari senyawa anorganik. Pengobatan Timbal Sianat Pb (CNO)2 dengan Amonia NH33 mendapatkan Amonium Sianat NH34CNO; Senyawa ini memang terbentuk, tetapi ketika larutan dididihkan untuk mengkristalkan Amonium Sianat, ia berubah menjadi Urea.
Perubahan kimia ini adalah contoh dari Pengelompokan ulang internal, di mana jumlah atau kelas atom dalam molekul tidak berubah, tetapi hanya urutannya di dalamnya. Jenis transformasi ini sangat umum dalam kimia organik.
Penemuan Wöhler memprakarsai pengabaian teori kekuatan hidup, kemudian benar-benar dibuang dengan diikuti oleh persiapan banyak senyawa organik lainnya di laboratorium. Meskipun demikian, kualifikasi Anorganik dan Organik tetap ada, karena senyawa anorganik terkait dengan produk mineral dan senyawa organik, yang sebenarnya merupakan senyawa karbon dan hidrogen dan turunannya, adalah jenis yang dihasilkan oleh organisme hidup.
Meskipun hukum kimia umum berlaku sama untuk kedua senyawa, berbagai penyebab membenarkan dan membuat pembagian ini diperlukan. Dengan demikian, senyawa organik dan anorganik berbeda dalam sifat yang berbeda, seperti: Kelarutan disukai dalam pelarut organik (eter, alkohol, kloroform, dll.) dan dalam air, masing-masing, Stabilitas (senyawa organik terurai pada suhu yang relatif rendah), dan Sifat Reaksi; untuk senyawa anorganik mereka ionik, sederhana dan praktis seketika, dan untuk senyawa organik mereka kovalen, kompleks dan lambat.
Senyawa organik
Senyawa karbon dengan rantai hingga sembilan puluh atom diketahui. Itu rantai Atom karbon dapat linier dan bercabang dan memiliki ikatan kovalen tunggal atau memiliki ikatan rangkap dua atau rangkap tiga. Lebih dari 2.500 senyawa diketahui hanya mengandung Karbon dan Hidrogen (Hidrokarbon).
Isomerisme senyawa organik
Dalam senyawa anorganik, formula umumnya mewakili senyawa tunggal; jadi, hanya ada satu zat dengan rumus H2SW4. Molekul Asam Sulfat mengandung dua atom Hidrogen, satu dari Sulfur dan empat Oksigen, dalam susunan yang spesifik dan unik. Dalam senyawa organik adalah jarang terjadi. Jadi, misalnya, ada dua senyawa yang merespon rumus C2H6Atau, Etil Alkohol atau Etanol, dan Dimetil Eter.

Semakin kompleks molekulnya, yaitu semakin besar jumlah atom Karbon, semakin besar jumlah isomer yang mungkin.
Analisis Senyawa Organik
Analisis senyawa organik terdiri dari: analisis kualitatif, itu Analisis kuantitatif dan Analisis fungsional. Jika senyawa tersebut dalam keadaan tidak murni, maka senyawa tersebut sebelumnya dimurnikan dengan cara: Kristalisasi, Distilasi, Sublimasi, Ekstraksi, dll. Kriteria kemurnian dapat dinilai berdasarkan konstanta fisiknya, seperti titik leleh, titik didih, densitas, kelarutan, bentuk kristal, indeks bias, dll.
Itu analisis kualitatif Hal ini diverifikasi dengan menyelidiki keberadaan unsur-unsur yang membentuk senyawa, terutama Karbon, Hidrogen dan Nitrogen, dan kadang-kadang Halogen, Sulfur dan Fosfor.
Itu Analisis kuantitatif Hal ini dilakukan dengan menggunakan sebagai dasar metode yang digunakan untuk analisis kualitatif. Titik awalnya adalah sejumlah zat yang mengalami pembakaran, dan karbon dioksida dikumpulkan dan ditimbang. karbon dan uap air yang terbentuk untuk menghitung persentase Karbon dan Hidrogen dalam senyawa. Hasil analisis kuantitatif memudahkan perhitungan rumus empiris, meskipun rumus molekul hanya dapat ditemukan setelah penentuan berat molekul zat. Tetapi masalahnya belum terpecahkan, karena rumus molekul yang sama dapat bersesuaian dengan isomer yang berbeda.
Klasifikasi Senyawa Organik
Menurut strukturnya, senyawa organik dibagi menjadi senyawa: alifatik, aromatik kamu heterosiklik. Senyawa alifatik terkait dengan metana CH4, adalah rantai terbuka, kecuali sikloparafin, dan namanya berasal dari fakta bahwa lemak hewani dan nabati termasuk dalam kelompok ini.
Itu senyawa aromatik, rantai tertutup, terkait erat dengan benzena, C6H6, dan mereka berutang nama karena fakta bahwa banyak dari mereka memiliki bau yang harum dan menyenangkan.
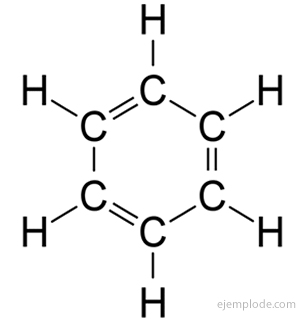
Cincin Benzena
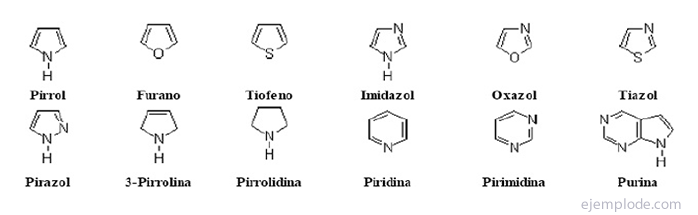
Itu senyawa heterosiklik Mereka adalah senyawa rantai tertutup yang cincinnya mengandung unsur selain karbon.
Karena konstitusi mereka, mereka adalah:
Hidrokarbon, yang pada gilirannya, karena jenis tautan yang dimilikinya, diklasifikasikan sebagai Alkana, Alkena kamu Alkuna. Selain itu, Sikloalkana, Benzena dan turunannya hanya terdiri dari Karbon dan Hidrogen termasuk dalam kategori ini.
Senyawa heterosiklik
Turunan terhalogenasi:R-X
Senyawa nitro:T-TIDAK2
Asam Sulfonat:R-SO3H
Nitril (ATAU alkil sianida) dan Isonitril:R-CN dan R-NC. Mereka berbeda dalam bagaimana atom Nitrogen terikat dalam molekul.
Alkohol:R-OH
Fenol: Senyawa berdasarkan tulang punggung yang terdiri dari cincin benzena dengan gugus hidroksil yang ditambahkan.

Eter:R-O-R
Mercaptans: R-SH
Tioeter:R-S-R
Asam tioa:R-COSH
Aldehid:R-CHO
Keton:R-CO-R
Asam karboksilat:R-COOH
Kamu keluar:R-COOM (M untuk logam)
Ester: R-COO-R
Anhidrida: R-CO-O-OC-R
Amina:R-NH2, R-NH-R, 2R-N-R
Karbohidrat jenis aldosa:-CHOH-CHOH-CHO
Karbohidrat tipe ketosa:-CHOH-CO-CH2Oh
Senyawa organologam:R-M-R
Logam-Alkil Halida:R-MX (juga dikenal sebagai Pereaksi Grignard)