Come si formano acidi, basi e sali?
Varie / / July 04, 2021
Ci sono diverse teorie per definire il acidi e il basi, tra cui l'Arrhenius, il Brönsted-Lowry e il Lewis.
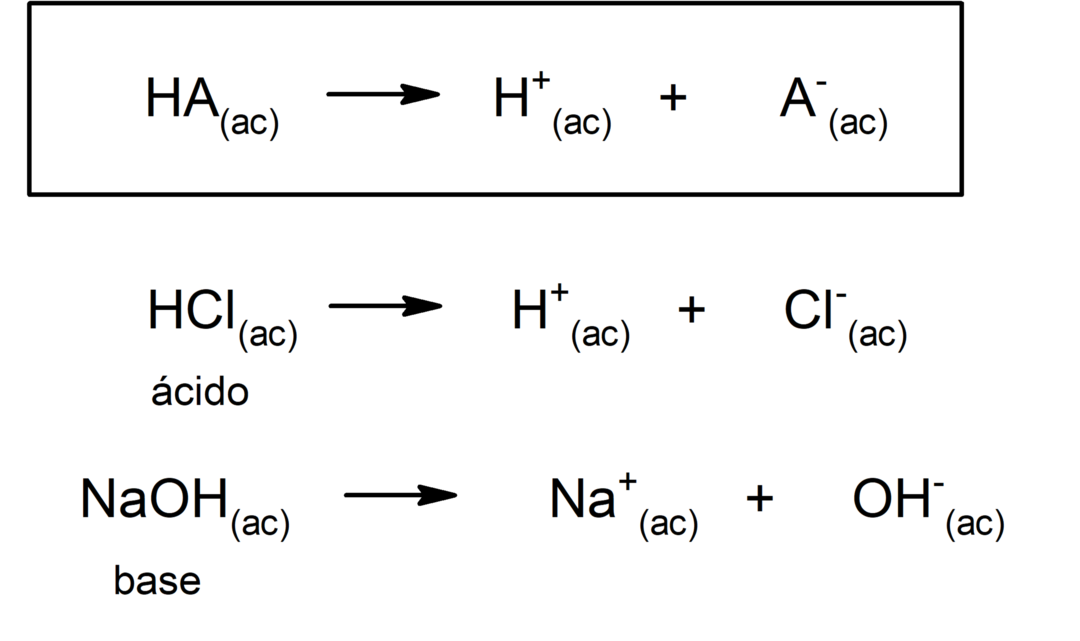
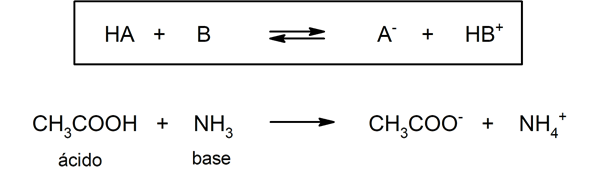
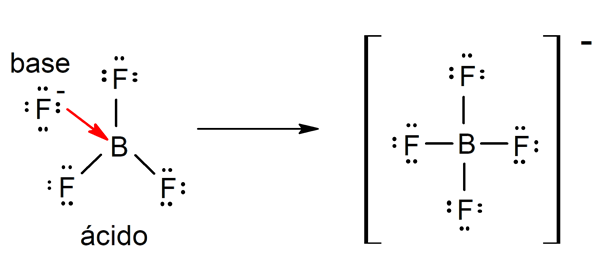
Tipo acidi ossacidi sono generalmente formati da reazione tra un ossido non metallico con acqua, mentre acidi del tipo idracidi sono formati dalla combinazione di a metalloide con idrogeno in soluzione acquosa. Per esempio:acido solforico (H2SW4) è un oxacid e acido cloridrico (HCl(AC)) è un idracido.
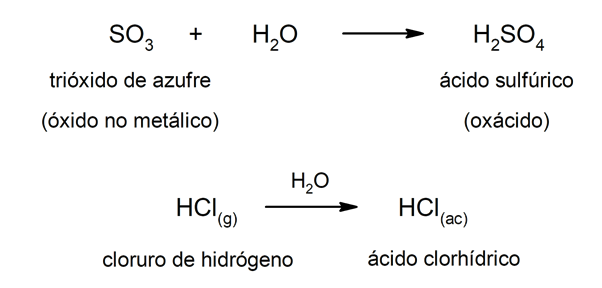
D'altra parte, le basi possono essere formate come risultato della reazione tra a ossido metallico E l'acqua. Per esempio: idrossido di magnesio (Mg (OH)2).
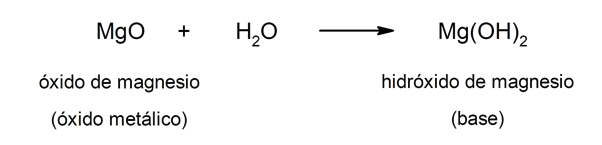
Caratteristiche generali di acidi e basi
In generale, gli acidi sono acido e corrosivo. Le basi sono anche corrosivo, di sapore amaro, caustico a contatto con la pelle e al tatto saponoso. D'altra parte, le soluzioni acide hanno a pH minore di 7, mentre le soluzioni basiche hanno un pH maggiore di 7.
Forza acida e basica
Il tendenza di un acido per dissociarsi e abbassare il pH è spesso indicato come "forza acida". Un acido è forte quando può dissociarsi completamente in soluzione acquosa ed è debole quando la sua dissociazione avviene parzialmente. Esempi di acidi forti sono il perclorico (HClO
4), solforico (H2SW4), iodidrico (HI), bromidrico (HBr), cloridrico (HCl) e nitrico (HNO3). L'acido acetico (CH3COOH), agrumi (C6H8O7) e benzoico (C6H5COOH) sono deboli.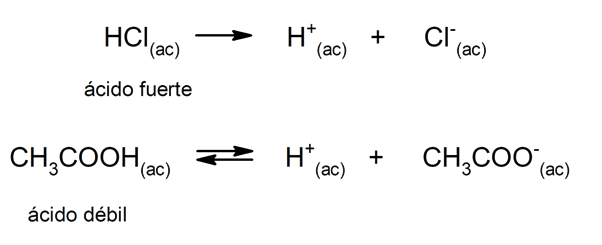
Allo stesso modo, possono essere considerati come basi forti quelli che si dissociano completamente in soluzione acquosa, e deboli quando la loro dissociazione avviene parzialmente. Esempi di basi forti sono idrossido di potassio (KOH), sodio (NaOH), litio (LiOH) e magnesio (Mg (OH)2). D'altra parte, l'ammoniaca (NH3) è una base debole.
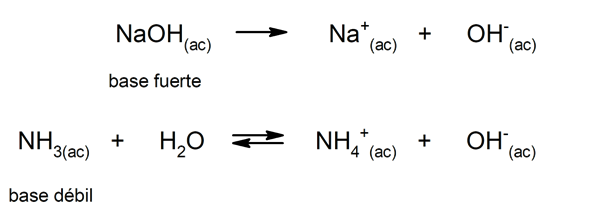
Come si formano i sali?
Il esci sono composti ionici di varia complessità, abbondanti in natura e generalmente formati dalla combinazione di acidi con basi in una reazione di neutralizzazione, che genera un rilascio di Acqua. Possono anche formarsi per reazione tra un metallo e un acido, tra un metallo e un non metallo, o per reazione tra diversi sali.
I sali possono essere classificati in:
Distribuzione e importanza
Gli acidi sono estremamente importanti sia in industria come nel natura. Ad esempio, l'acido cloridrico fa parte del nostro sistema digestivo ed è necessario per degradare i composti nutritivi presenti in cibo. L'acido desossiribonucleico, meglio noto come DNA, costituisce i cromosomi, che è il luogo in cui vengono codificate le informazioni genetiche necessarie per la loro codifica. esseri viventi moltiplicarsi e svilupparsi. L'acido borico è un componente importante nell'industria del vetro.
Il carbonato di calcio È un sale molto abbondante in vari tipi di rocce calcaree. Per quota elevata temperature (900°C) da carbonato di calcio, ossido di calcio o calce viva si ottiene. L'aggiunta di acqua alla calce produce idrossido di calcio, chiamato calce spenta, che è una base. Questi materiali sono usati nella costruzione.
Segui con:

