20 esempi di sali acidi
Varie / / July 04, 2021
Nel chimica inorganica i sali sono chiamati composti che si ottengono quando a acido i suoi atomi di idrogeno sono sostituiti da cationi metallici (anche se a volte da cationi non metallici, ad esempio il catione ammonio, NH4+). Nel caso specifico di sali acidi, gli idrogeni dell'acido sono parzialmente sostituiti, cioè almeno un idrogeno non sostituito rimane come parte del sale. In quanto si distinguono da sali neutri, dove gli idrogeni dell'acido sono totalmente sostituiti.
Il esci si formano solitamente attraverso la reazione tra a acido e un idrossido (base). In queste reazioni, normalmente la base perde i suoi gruppi ossidrilici (-OH) e l'acido li perde. atomi idrogeno (H), formando un sale neutro; ma se l'acido in questione conserva almeno uno dei suoi atomi di idrogeno, alterando la carica elettrica della reazione, otterremo un sale acido o un sale idrogenato.
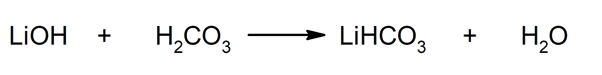
Così, ad esempio, il bicarbonato di litio e l'acqua si ottengono dalla reazione tra idrossido di litio e acido carbonico:
Nomenclatura dei sali acidi
I sali acidi possono essere nominati secondo tre tipi nomenclatura più comune:
Esempi di sali acidi
- Bicarbonato di sodio (NaHCO3). Detto anche idrogenocarbonato di sodio (IV), è un solido cristallino bianco, solubile in acqua, che si trova in natura allo stato minerale oppure può essere prodotto in laboratorio. È uno dei sali acidi più conosciuti ed è ampiamente utilizzato in pasticceria, farmacologia o nella produzione di yogurt.
- Bicarbonato di litio (LiHCO3). Questo sale acido è stato utilizzato come agente catturante per la CO2 in situazioni in cui tale gas è indesiderabile, come nelle missioni spaziali nordamericane "Apollo".
- Potassio diidrogeno fosfato (KH2PO4). È un solido cristallino, inodore, solubile in acqua, ampiamente utilizzato in varie industrie come lievito di yeast cibo, agente chelante, fortificante nutrizionale e coadiuvante nei processi fermentativi.
- bisolfato di sodio (NaHSO4). È un sale acido formato dalla neutralizzazione dell'acido solforico. È ampiamente utilizzato industrialmente nella raffinazione dei metalli e dei prodotti per la pulizia. Sebbene sia altamente tossico per alcuni echinodermi, viene utilizzato come additivo negli alimenti per animali domestici e nella produzione di gioielli.
- Sodio idrogeno solforato (NaHS). È un composto pericoloso da maneggiare, poiché è altamente corrosivo e tossico. Può causare gravi ustioni alla pelle e danni agli occhi poiché è anche combustibile.
- Calcio idrogeno fosfato (CaHPO4). È usato come integratore alimentare in cereali per il bestiame. È un solido insolubile in acqua ma capace di cristallizzare quando idratato consumandone due molecole d'acqua.
- Ammonio idrogenocarbonato ([NH4] HCO3). Conosciuto anche come "bicarbonato di ammonio", viene utilizzato nell'industria alimentare come lievito chimico, anche se ha lo svantaggio di intrappolare l'ammoniaca e dare un cattivo sapore al cibo se usato eccesso. Viene anche utilizzato negli estintori, nella produzione di pigmenti e per espandere la gomma.
- Bicarbonato di Bario (Ba [HCO3]2). È un sale acido che riscaldato può invertire la sua reazione di produzione ed è altamente instabile, tranne che in soluzione. È ampiamente usato nell'industria ceramica.
- bisolfito di sodio So (NaHSO3). Questo sale è estremamente instabile e in presenza di ossigeno si trasforma in solfato di sodio (Na2SW4), motivo per cui viene utilizzato nell'industria alimentare come conservante e disseccante degli alimenti. È un agente riducente estremo e comunemente usato dall'uomo, utilizzato anche per fissare i colori.
- citrato di calcio (AC3[C6H5O7]2). Comunemente noto come sale amaro, viene utilizzato come conservante alimentare e come integratore alimentare quando è legato all'aminoacido lisina. È una polvere bianca, inodore e cristallina.
- Fosfato monocalcico (Ca [H2PO4]2). È un solido incolore che si ottiene dalla reazione di idrossido di calcio e acido fosforico, ampiamente utilizzato come agente lievitante o come fertilizzante nei lavori agricoli.
- Fosfato bicalcico (CaHPO4). Conosciuto anche come calcio monoidrogeno fosfato, ha tre diverse forme cristalline che vengono utilizzate come additivo negli alimenti ed è presente nei dentifrici. Inoltre, si forma naturalmente nei calcoli renali e nei cosiddetti "calcoli renali".
- Fosfato di monomagnesio (MgH4P2O8). È un sale bianco, cristallino e inodore, parzialmente solubile in acqua. Viene utilizzato nella conservazione degli alimenti, come acidificante, come correttore di acidità o agente nel trattamento di farine.
- Diacetato di sodio (NaH [C2H3O2]2). Questo sale viene utilizzato come aromatizzante e conservante nei pasti, che previene o ritarda la comparsa di funghi e micobatteri, sia nei prodotti sottovuoto come i prodotti a base di carne che nell'industria delle farine.
- Bicarbonato di calcio (Ca [HCO3]2). È un sale idrogenato che ha origine dal carbonato di calcio, presente in minerali come calcare, marmo e altri. Questa reazione prevede la presenza di acqua e CO2, quindi può manifestarsi spontaneamente in grotte e grotte ricche di calcio.
- Fluoruro acido di rubidio (RbHF). Questo sale è ottenuto dalla reazione di acido fluoridrico (idrogeno e fluoro) e rubidio, un metallo alcalino. Il risultato è un composto tossico e corrosivo che deve essere maneggiato con cautela.
- Fosfato di monoammonio ([NH4] H2PO4). È un sale solubile in acqua prodotto dalla reazione di ammoniaca e acido fosforico. Di solito è usato come fertilizzante poiché dona al terreno il nutrienti di azoto e fosforo necessari per la crescita delle piante. Fa anche parte della polvere ABC negli estintori.
- Zinco idrogeno ortoborato (Zn [HBO3]). È un sale utilizzato come antisettico e come additivo nella fabbricazione della ceramica.
- Fosfato monosodico (NaH2PO4). Viene utilizzato principalmente nei laboratori, come "tampone" o soluzione tampone, che impedisce sbalzi di pH di una soluzione.
- Potassio idrogeno ftalato (KHP). Detto anche “ftalato acido di potassio”, è un sale solido e stabile nell'aria ordinaria, motivo per cui viene spesso utilizzato come standard primario nelle misurazioni di pH. È anche utile come agente tampone in reazioni chimiche.
Segui con:

