20 esempi di alcani
Varie / / July 04, 2021
Il alcani sono una specie di idrocarburi in cui un numero variabile di atomi di carbonio sono uniti tra loro da singoli legami, come uno scheletro, e ogni atomo di carbonio è a sua volta attaccato ad atomi di idrogeno, che possono eventualmente essere sostituiti da altri atomi o gruppi funzionali. Per esempio: cloroformio, metano, ottano.
Il formula molecolare degli alcani a catena lineare aperta è CnH2n + 2, dove C rappresenta il carbonio, H rappresenta l'idrogeno e n rappresenta il numero di atomi di carbonio. Gli alcani sono idrocarburi saturi, il che significa che non hanno doppi o tripli legami. Per nominarli, usi il suffisso "-Ano" dopo aver nominato la catena di carbonio usando il prefisso corrispondente al numero di atomi di carbonio (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7), ecc.).
Ti può servire:
Classificazione degli alcani
All'interno degli alcani sono generalmente riconosciuti due grandi gruppi: catena aperta (detta anche aciclica) e catena chiusa (o ciclica).
Quando il
composti a catena aperta Non presentano alcuna sostituzione degli idrogeni che accompagnano ogni atomo di carbonio, sono detti alcani lineari: sono gli alcani più semplici. Quando presentano una sostituzione di uno dei loro idrogeni con una o più catene di carbonio, sono chiamati alcani ramificati. I sostituenti più comuni sono i gruppi etilici (CH3CH2-) e metile (CH3-).Dal canto loro, esistono composti con un solo ciclo nella molecola (monociclico) e altri con più (policiclici). Il alcani ciclici possono essere omociclici (si formano con l'esclusivo intervento di atomi di carbonio) o eterociclici (a cui partecipano altri atomi, ad esempio ossigeno o zolfo).
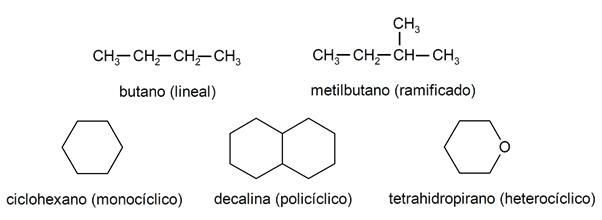
Proprietà fisiche degli alcani
Generalmente, Proprietà fisiche degli alcani sono condizionati dalla massa molecolare (a sua volta legata alla lunghezza della catena di carbonio). Quelli con il minor numero di atomi di carbonio sono gassoso per temperatura ambiente, quelli che vanno da 5 a 18 atomi di carbonio sono liquidi, e sopra questo numero sono solido (simile alla cera).
Essendo meno densi dell'acqua, tendono a galleggiare su di essa. In generale, gli alcani sono insolubili in acqua e solubili in solventi organici.
Il punto di bollente e di fusione degli alcani dipende dalla loro massa molecolare, vale a dire dalla lunghezza della catena di carbonio, sebbene dipendano molte volte anche dalla disposizione spaziale degli atomi. Gli alcani lineari e ciclici hanno punti di ebollizione più alti di quelli ramificati.
Proprietà chimiche degli alcani
Gli alcani sono caratterizzati dall'essere composti chimici di molto scarsa reattività, motivo per cui sono dette anche "paraffine" (in latino, parum affinis significa "bassa affinità"). Sono composti che hanno un'energia di attivazione molto alta quando sono coinvolti in reazioni chimiche. La reazione più importante che possono subire gli alcani è combustione generando, in presenza di ossigeno, calore, anidride carbonica e acqua.
Gli alcani sono alla base di un'importante varietà di reazioni associate a processi industriali molto importante, essendo i combustibili più tradizionali. Appaiono anche come prodotti finali di processi biologici come la fermentazione metanogenica svolta da alcuni microrganismi.
Esempi di alcani
Alcuni esempi di alcani (compresi alcuni ben noti lineari e ramificati) sono:
- Cloroformio (nome di fantasia del triclorometano; CHCl3). I vapori di questa sostanza venivano usati come anestetici. È stato interrotto per questo scopo perché è stato trovato danneggiato organi importanti, come il fegato o i reni. Il suo uso oggi è principalmente come solvente o refrigerante.
- Metano (CH4). È l'alcano più semplice di tutti: è composto da un solo atomo di carbonio e quattro atomi di idrogeno. È un gas che si forma naturalmente dalla decomposizione di diversi substrati organici ed è il componente principale del gas naturale. In tempi recenti è stato riconosciuto come uno dei gas che maggiormente contribuisce al cosiddetto effetto serra.
- Ottano (C8H18). È l'alcano a otto atomi di carbonio ed è di grande importanza poiché determina la qualità finale della nafta, che è un mescolare di vari idrocarburi. Questa qualità è misurata dal numero di ottano o di ottano del carburante, che prende come riferimento uno a bassa detonazione (indice 100) e uno ad alta detonazione (indice 0).
- Esano (C6H14). È un solvente importante, la sua inalazione dovrebbe essere evitata poiché è molto tossico.
- Butano (C4H10). Insieme al propano (C3H8), costituiscono i cosiddetti gas di petrolio liquefatto (GPL), che si formano nelle sacche di gas durante il processo di estrazione del petrolio. Attualmente viene promossa la sostituzione della benzina o del gasolio con il GPL come carburante poiché è di un idrocarburo più ecologico (emette solo anidride carbonica e acqua durante la sua combustione).
- Icosano (C20H42). È l'alcano a venti atomi di carbonio (il prefisso 'ico' significa venti)
- ciclopropano (C3H6). Anticamente veniva usato come anestetico
- n-eptano (C7H16). È quello che viene preso come riferimento per il punto zero della scala degli ottani della benzina, che sarebbe il meno desiderabile, poiché brucia in modo esplosivo. Si ottiene dalla resina di certi impianti.
- 3-etil-2,3-dimetilpentano (C9H20)
- 2-metilbutano (C5H12)
- 3-cloro-4-n-propileptano (C10H21Cl)
- 3,4,6-trimetileptano (C10H22)
- 1-bromo-2-feniletano (C8H9Br)
- 3-etil-4-metilesano (C9H18)
- 5-isopropil-3-metilnonano (C13H28)
- cubano (C8H8)
- 1-bromopropano (C3H7Br)
- 3-metil-5-n-propilottano (C12H26)
- 5-n-butil-4,7-dietildecano (C18H28)
- 3,3-dimetildecano (C12H26)



