100 esempi di elementi chimici
Varie / / November 13, 2021
Il elementi chimici sono un tipo di materia che per nessuna procedura o reazione chimica possono essere ridotti o scomposti in altri elementi più semplici. Per questo si può dire che un elemento è tutto importa fatto da atomi della stessa e unica classe, cioè atomi che hanno lo stesso numero atomico (uguale numero di protoni), sebbene abbiano massa atomica diversa. Per esempio: zolfo, boro, cromo, stagno.
La prima definizione di elemento chimico è stata introdotta da Lavoisier nel Traité Élémentaire de Chimie, nel 1789. Già nel XVIII secolo, Lavoisier suddivise le sostanze semplici in quattro gruppi:
Tavola periodica degli elementi
Oggi si conoscono 118 elementi chimici. Sono tutti raccolti, classificati e organizzati secondo molte delle loro proprietà in uno schema grafico noto come Tavola Periodica degli Elementi, originariamente creato dal chimico russo Dimitri Mendeleev nel 1869. La Tavola Periodica è composta da 18 gruppi (colonne) e 7 periodi (righe), in cui si trovano gli elementi chimici.
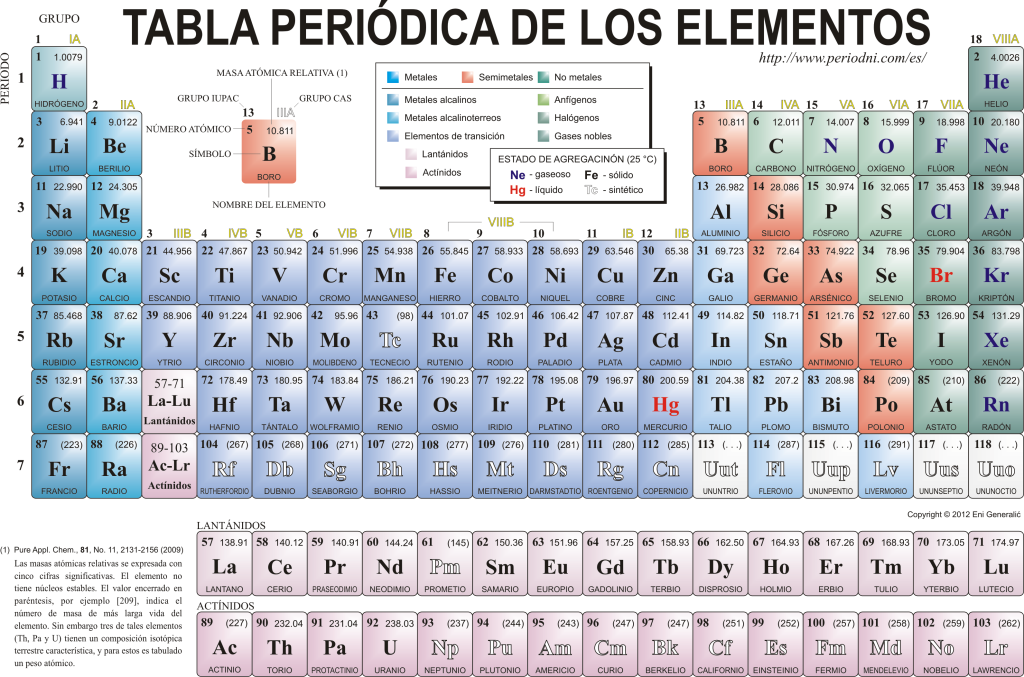
Il gruppi principali che si possono trovare in questa tabella sono:
I metalli alcalini (Gruppo 1), i metalli alcalino-terrosi (Gruppo 2), la famiglia dello scandio, che comprende le terre e gli attinidi (Gruppo 3), la famiglia del titanio (Gruppo 4), la famiglia del vanadio (Gruppo 5), la famiglia del cromo (Gruppo 6), la famiglia del manganese (Gruppo 7), la famiglia del ferro (Gruppo 8), la famiglia del cobalto (Gruppo 9), la famiglia del nichel (Gruppo 10), la famiglia del rame (Gruppo 11), la famiglia dello zinco (Gruppo 12), gli elementi della terra (Gruppo 13), gli elementi carbonidi, in questo gruppo è Il carbonio, che costituisce la base della vita sulla Terra (Gruppo 14), gli elementi azotati (Gruppo 15), gli elementi anfigenetici, comprende l'ossigeno, elemento fondamentale per il respirazione del esseri viventi (Gruppo 16), elementi alogeni (Gruppo 17) e gas nobili (Gruppo 18).
Molti di questi elementi hanno isotopi stabili o radioattivi, cioè lo stesso elemento chimico, ad esempio l'idrogeno (H), può avere diversi isotopi (1H, 2H, 3H). Ciò significa che ogni atomo di isotopo ha lo stesso numero di protoni (il che implica che appartiene allo stesso elemento chimico) e un diverso numero di neutroni.
Alcuni isotopi non sono stabili (radioattivi), cioè disintegrarsi in un certo tempo, emettendo determinate particelle (neutroni, fotoni, particelle alfa, tra le altre) e generando altri isotopi stabili o radioattivi. Gli elementi chimici hanno proprietà come il punto di bollente e quello di fusione, elettronegatività, densità e raggio ionico, tra gli altri. Queste proprietà sono importanti perché ci consentono di prevederne il comportamento, la reattività, ecc.
Come sono presentati gli elementi nella tavola periodica?
Ogni elemento chimico è caratterizzato nella Tavola periodica utilizzando una certa simbologia. In primo luogo, al centro di ogni quadrato il suo simbolo universale, che consiste in uno o due lettere (per convenzione, se ci sono due lettere, la prima si scrive maiuscola e la successiva minuscola).
Sopra ea sinistra appare in caratteri piccoli su numero atomico, che è quello che indica il numero di protoni che ha questo elemento. Sotto il simbolo dell'elemento compare il suo nome e sopra, a sinistra, il suo nome. massa atomica parente. Inoltre, il colore con cui è rappresentato il simbolo dell'elemento ne indica lo stato di aggregazione (secondo la rappresentazione utilizzata in ciascuna Tavola Periodica).
I diversi elementi presenti raggi atomici variabili e, all'aumentare del numero di protoni nel nucleo, maggiore è l'attrazione che il nucleo esercita sugli elettroni, quindi il raggio atomico tende a diminuire. Quando il raggio atomico è piccolo, gli elettroni al livello più esterno della nuvola sono molto attratti dal nucleo, quindi non si arrendono facilmente. L'opposto accade con elementi con alti raggi atomici: cedono facilmente i loro elettroni esterni.
Pertanto, il raggio atomico aumenta dall'alto verso il basso quando passiamo attraverso i gruppi della tavola periodica e diminuisce da sinistra a destra mentre attraversiamo i loro periodi.
Esempi di elementi chimici
| Elemento chimico | Simbolo |
| Attinio | AC |
| Alluminio | Al |
| Americio | A.M |
| Antimonio | Sb |
| Argon | Ar |
| Arsenico | Asso |
| Astat | A |
| Zolfo | S |
| Bario | Ba |
| Berillio | Essere |
| Berkelio | Bk |
| Bismuto | Bi |
| Bohrio | bh |
| Boro | B |
| Bromo | Br |
| Cadmio | CD |
| Calcio | AC |
| Californio | Cf |
| Carbonio | C |
| Cerio | EC |
| Cesio | Cs |
| Cloro | Cl |
| Cobalto | Co |
| Rame | Cu |
| Cromo | Cr |
| Curio | Cm |
| Darmstadio | Ds |
| disprosio | Dy |
| dubnio | Db |
| Einsteinio | È |
| Erbio | Er |
| Scandio | Sc |
| Lattina | Sn |
| Stronzio | Sig |
| europio | Unione Europea |
| Fermio | Fm |
| Fluoro | F |
| Incontro | P |
| Francesco | Fr |
| gadolinio | Gd |
| Gallio | Ga |
| Germanio | Ge |
| Afnio | HF |
| Hassio | Hs |
| Elio | io ho |
| Idrogeno | H |
| Ferro | Fede |
| Olmio | come |
| indiano | Nel |
| Iodio | io |
| Iridio | Andare |
| Itterbio | Yb |
| Ittrio | sì |
| Krypton | Kr |
| Lantanio | Il |
| Lorenzo | Lr |
| Litio | Li |
| lutezio | lun |
| Magnesio | Mg |
| Manganese | mn |
| Meitnerius | Mt |
| Mendelevio | Md |
| Mercurio | Hg |
| Molibdeno | Mo |
| Neodimio | N / A |
| Neon | no |
| Nettunio | Np |
| Niobio | Nb |
| Nichel | Nessuno dei due |
| Azoto | no |
| Nobelio | Non |
| Oro | Au |
| Osmio | voi |
| Ossigeno | O |
| Palladio | P.S |
| Argento | Ag |
| Platino | Pt |
| Condurre | Pb |
| Plutonio | Pu |
| Polonio | po |
| Potassio | K |
| praseodimio | prima |
| Promettere | P.m |
| protattinio | papà |
| Radio | RA |
| Radon | Rn |
| renio | Ri |
| rodio | Rh |
| Rubidio | Rb |
| Rutenio | Ru |
| Rutherfordio | Rf |
| Samario | Voi |
| Seaborgio | Sg |
| Selenio | lo so |
| Silicio | sì |
| Sodio | N / A |
| Tallio | Tl |
| tantalio | Ta |
| tecnezio | Tc |
| Tellurio | Tè |
| Terbio | Tb |
| Titanio | voi |
| Torio | questo |
| Tulio | Tm |
| Copernico | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | fl |
| ununseptio | Uus |
| Ununtrium | Uut |
| Uranio | O |
| Vanadio | V |
| Tungsteno | W |
| Xeno | Xe |
| Zinco | Zn |
| Zirconio | Zr |

Segui con:

