Esempio di basi chimiche
Chimica / / November 13, 2021
In Chimica Generale, Le basi sono una categoria di prodotti chimici che assolvono a diverse funzioni:
-Reagire con gli acidi in una neutralizzazione, producendo un Sale e Acqua.
-Regola il potenziale di idrogeno, pH, aumentandone il valore, se vengono versati nel mezzo dove si trova una reazione.
-Correre come Reagenti chimici per un gran numero di reazioni.
Le Basi possono essere specie diverse, entrambe le Chimica inorganica a partire dal Chimica organica, Come il Idrossidi, il ammine e il Alcoli, per esempio.
Per definire il comportamento delle Basi vengono utilizzate le tre principali Teorie Acido-Base: quella di Arrhenius, quella di Brönsted-Lowry e quella di Lewis.
Le basi secondo Arrhenius
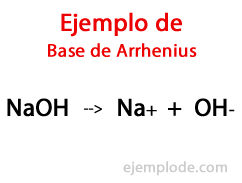
Secondo il chimico svedese Svante Arrhenius, le Basi sono quelle sostanze chimiche che fornire ioni ossidrile (OH-) ad un mezzo di reazione, specialmente se è una soluzione acquosa. Quindi, con gli ioni ossidrile disponibili, ci sarà a pH alcalino, cioè con un valore maggiore di 7, e fino a 14 a seconda di quanta Base è presente al momento della misurazione.
Questa è una delle teorie più semplici e pratiche da applicare, poiché non ha complicazioni per differenziare le sostanze che prendono parte alla reazione. È ben noto quale sia l'acido e quale la base.
All'interno di questa teoria, ci sono indiscutibilmente idrossidi inorganici, come l'idrossido di sodio (NaOH) e l'idrossido di potassio (KOH).
Le basi secondo Brönsted-Lowry
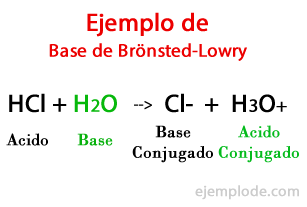
Secondo la teoria formulata dal danese Johannes Brönsted e gli inglesi Thomas Martin Lowry, una base è una specie chimica capace di ricevere i Protoni che un altro, l'Acido, sta per dare durante una reazione chimica. Il protone è generalmente correlato alla carica positiva che lo caratterizza, quindi possiamo associarlo nuovamente agli ioni idrogeno (H+).
Quando lo scambio avviene nella reazione chimica, i prodotti sono denominati: "Base Acida Coniugata", e "Base Acida Coniugata", in base ai reagenti che li hanno formati.
Per questa teoria, il ammoniaca (NH3) è il caso più rappresentativo. Per Brönsted e Lowry, le sostanze in grado di trattenere gli ioni idrogeno (H+) sono le basi. In questo caso l'Ammoniaca, comportandosi come Base, acquisirà nella sua struttura un Idrogeno, consolidandosi come ione Ammonio (NH4+), con l'eccesso di carica positiva di Idrogeno. L'ammonio è l'acido coniugato dell'ammoniaca.
Ammine, composti organici derivati dall'ammoniaca (NH3), come la metilammina (CH (3NH2), quando in soluzione si comportano come Basi, e sono in grado di ricevere cariche positive nella loro struttura, sia dall'Idrogeno che dal Carbocatione.
Un carbocatione è uno ione organico formato come una catena idrocarburica, che in assenza di uno ione negativo, che Può essere l'Idrossile (OH-) o un Alogeno (Cl-, Br-), tende a legarsi ad un sito che può riceverlo, che sarà il Base.
Le basi secondo Lewis
Lo scienziato americano Gilbert lewis ha sottolineato nella sua teoria acido-base che le basi sono quelle sostanze che sono in grado di contribuire con le loro coppie di elettroni liberi affinché un altro completi il suo ottetto.
Questa Teoria Acido-Base è un complemento per riaffermare la validità della sua Regola dell'Ottetto, in cui descrive come gli atomi acquisiscono stabilità raggiungendo un numero di otto elettroni nel loro ultimo guscio, utilizzando il legame covalente
Lo ione idrossile è un buon esempio di una base di Lewis. Ha una coppia di elettroni liberi su cui può raggiungere uno ione idrogeno che non ha elettroni. Si formerà una molecola di Acqua. Si formerà così l'ottetto per l'ossigeno della molecola, e gli idrogeni, che sono atomi più piccoli, avranno la loro coppia di elettroni che li renderà stabili.

Usi di basi importanti
Il Idrossido di sodio NaOH Viene generalmente utilizzato in soluzione acquosa per pulire il grasso solidificato nelle stufe domestiche e industriali sciogliendolo efficacemente. Viene anche utilizzato, in soluzione concentrata, quando si verificano sversamenti imprevisti di una sostanza acida, per neutralizzarla.
Il Magnesio Idrossido Mg (OH)2 Viene utilizzato in una soluzione chiamata "Latte di Magnesia", per risolvere il bruciore di stomaco, neutralizzandolo. È venduto in farmacia.
Il Idrossido di potassio KOH Viene utilizzato come reagente per i processi di saponificazione, trasformando i grassi in sapone.
Il ammoniaca NH3 Viene utilizzato nella sua forma gassosa come refrigerante industriale, soprattutto nei produttori di ghiaccio. È molto pericoloso da usare, poiché respirare una concentrazione di 5 milligrammi per litro nell'aria può essere fatale.
Esempi di basi chimiche
Acqua H2O
ammoniaca NH3
Idrossido di sodio NaOH
Idrossido di potassio KOH
Magnesio Idrossido Mg (OH)2
Idrossido di calcio Ca (OH)2
Idrossido di alluminio Al (OH)3
Idrossido di ammonio NH4Oh
Ferro idrossido Fe (OH)2
Ferro idrossido Fe (OH)3
Ione idrossile (OH-)
Ione cloruro (Cl-)
Ione bromuro (Br-)