Concetto in definizione ABC
Varie / / April 22, 2022
definizione del concetto
Gli azeotropi sono miscele di composti chimici, con una composizione definita, che bollono a determinate temperature. La caratteristica fondamentale è che la miscela si comporta come se fosse un'unica sostanza pura, conservandone le proprietà e garantendo facilità di manipolazione.

Ingegnere chimico
La miscela può essere data da due o più componenti e suoi composizione è lo stesso sia in fase liquida che in fase gassosa, questo genera somiglianze con sostanze pure. Da ciò si deduce facilmente che tale miscela non può essere separata nei suoi componenti mediante procedimenti quali distillazioni frazionate poiché, come detto sopra, manterrà le sue proporzioni, comportandosi come se fosse un singolo componente.
Un'altra caratteristica è che il punto di ebollizione di questa miscela può essere superiore, inferiore o addirittura uguale a quello di uno dei suoi componenti. Quando l'azeotropo bolle a temperatura di massimo ebollizione, è noto come azeotropo massimo e quando lo fa alla temperatura più bassa possibile è noto come azeotropo minimo. Ciò significa che l'azeotropo minimo ha un punto di ebollizione inferiore rispetto ai suoi componenti puri e viceversa con l'azeotropo massimo. Ad esempio, nella miscela metanolo - benzene, l'azeotropo è minimo (0,61 benzene - 0,39 metanolo in frazioni molare) il cui punto di ebollizione è 58 °C, in una vasca dove il punto di ebollizione del benzene è 80 °C e quello del metanolo 65°C
Azeotropi minimi e massimi
Ora... da dove viene un azeotropo? Quando c'è una deviazione dal Legge Raoult, cioè la tensione di vapore della miscela azeotropica non è direttamente correlata alla sua frazione molare, è quando sorge il concetto di miscela azeotropica. Queste deviazioni si verificano quando i componenti si attraggono o si respingono in modo significativo, cioè le forze intermolecolari sono molto diverse nei diversi composti.
Quando la deviazione è positiva, abbiamo l'azeotropo minimo, mentre se la deviazione è negativa, abbiamo l'azeotropo massimo. Per comprendere meglio questo concetto, diamo un'occhiata ad alcuni grafici:
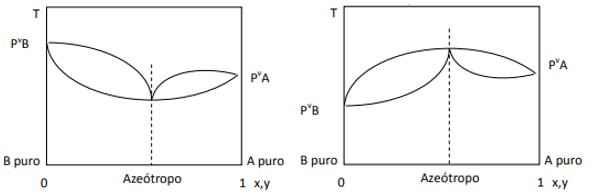
Qui osserviamo che, se la miscela fosse ideale, per la legge di Raoult, le tensioni di vapore dei componenti puri dovrebbero essere unite da una linea retta, poiché ebbene, c'è una deviazione da quella legge che provoca la formazione di azeotropi minimo e massimo, a seconda che vi sia maggiore o minore affinità tra i componenti. Quando la deviazione dalla legge di Raoult è negativa, come nella figura a sinistra, è un minimo a diagramma di pressione, ma un massimo nel diagramma di temperatura (quindi, azeotropo del massimo). D'altra parte, se la deviazione è positiva alla legge di Raoult, sarà un massimo nella pressione vs. composizione, ma un minimo nel diagramma di temperatura vs. composizione (qui abbiamo un azeotropo minimo). Non confondere i diagrammi pressione vs. composizione e temperatura vs. composizione.
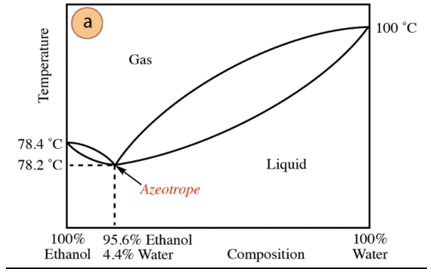
Nel caso della miscela etanolo-acqua, esiste un azeotropo minimo la cui composizione è 95,6% di etanolo e 4,4% di acqua. La temperatura di ebollizione della miscela azeotropica è di 78,2 °C inferiore a quella dei componenti puri. Supponiamo quindi di distillare una miscela acqua-etanolo con un alto contenuto di acqua (vicino al 100%). Non sarà possibile ottenere alcol puro, poiché in ogni fase di distillazione si otterranno frazioni maggiori. di etanolo, ma non raggiungendo mai il 100%, si avvicinerà gradualmente alla composizione della miscela azeotropica (il punto più basso sotto). Ecco perché, come l'acqua, ha la tendenza a formare azeotropi minimi composti organici (dato il tipo di forze intermolecolari che interagiscono), è necessario rimuovere preventivamente l'acqua dalla miscela per ottenere il composto puro. Oppure, una volta ottenuto l'azeotropo, metodi di estrazione di acqua aggiuntiva.
In base a quanto sopra, non è un caso trovare alcolici (al supermercato e farmacia) al 95%, è il prodotto più economico che si possa ottenere. Per ottenere alcol puro, è necessario "rompere" l'azeotropo tecnica addizionali, come l'uso di agenti essiccanti o distillazioni azeotropiche. La distillazione azeotropica consiste nell'aggiungere un componente extra alla miscela che agisce per trascinamento e per interazione con uno qualsiasi dei componenti della miscela (affinità maggiore) può essere rimosso dalla miscela.
Argomenti in azeotropi
