20 esempi di ammidi
Esempi / / November 06, 2023
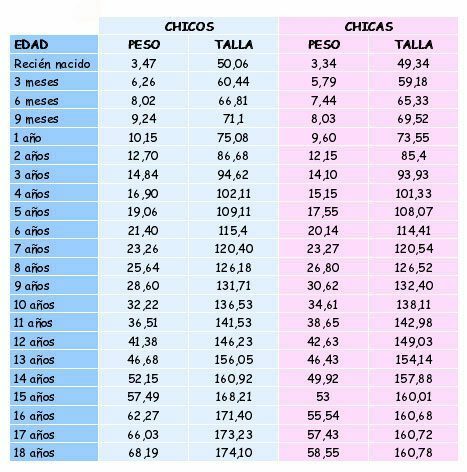
IL ammidi Sono composti chimici organici derivati degli acidi carbossilici, dove il gruppo ossidrile (-OH) del gruppo carbossilico (-COOH) dell'acido è sostituito da un gruppo amminico (-NH2, -NH-R, -N-(R)2, essendo R una qualsiasi catena di carbonio).
Le ammidi lo sono molecole organiche che contengono il gruppo ammidico, che è formato da un gruppo carbonilico e un gruppo amminico. Per esempio: etanammide, propanammide e N-metil-etanammide.

- Guarda anche: Aldeidi e chetoni
Tipi di ammidi
Le ammidi possono essere classificate in base al numero di idrogeni (che sono attaccati all'azoto del gruppo amminico) che sono stati sostituiti da diversi gruppi sostituenti. In questo senso, ci sono ammidi primarie, secondarie e terziarie.
- Ammidi primarie. Sono ammidi che non hanno sostituiti gli idrogeni del gruppo amminico. Per esempio:

- Ammidi secondarie. Sono ammidi a cui è sostituito uno degli idrogeni del gruppo amminico. Per esempio:

- Ammidi terziarie. Sono ammidi in cui sono sostituiti due degli idrogeni del gruppo amminico. Per esempio:

Nomenclatura delle ammidi
Secondo la nomenclatura comune, le ammidi vengono denominate derivati degli acidi carbossilici seguendo le seguenti regole:
- Il carbonio corrispondente al gruppo carbonilico si trova in posizione 1 e da questo carbonio si sceglie la catena carboniosa più lunga. Per esempio:

- Le ammidi primarie vengono denominate utilizzando il prefisso corrispondente al numero di atomi di carbonio dell'acido carbossilico che le ha originate. Per esempio:

Secondo l’Unione Internazionale di Chimica Pura e Applicata (IUPAC), ammine Vengono denominati utilizzando le seguenti regole:
- Le ammidi secondarie e terziarie vengono denominate utilizzando il prefisso corrispondente al numero di atomi di carbonio dell'acido carbossilico che le ha originate. Inoltre, per ogni idrogeno del gruppo amminico sostituito viene posto un N. Pertanto, i diversi sostituenti vengono nominati indicandone la quantità e alla fine del nome viene posta la parola ammide. Per esempio:

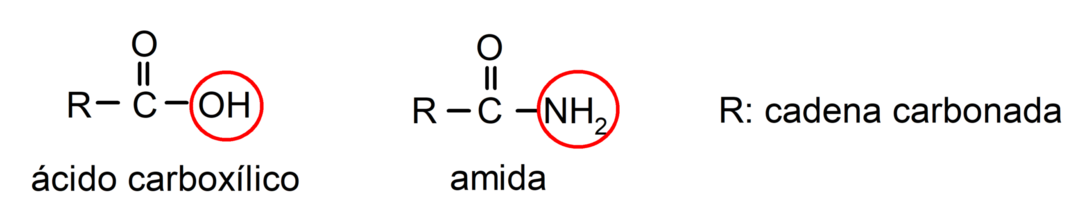
- Quando la molecola ha gruppi prioritari rispetto al gruppo ammidico, allora l'ammide viene denominata sostituente. In questi casi il gruppo ammidico è denominato carbamoile. Per esempio:
- Quando la molecola è formata da un ciclo e da un gruppo ammidico, si prende il ciclo come catena principale e si mette il suffisso -carbossammide. Per esempio:

Proprietà fisiche delle ammidi
- Le ammidi sono solide a temperatura ambiente, ad eccezione della metanammide.
- Hanno punti di ebollizione elevati, anche superiori a quelli dei corrispondenti acidi carbossilici.
- Le ammidi sono buoni solventi.
- Sono basi deboli.
Reazioni chimiche delle ammidi
- Le ammidi reagiscono con un acido acquoso per formare il corrispondente acido carbossilico e un sale di ammonio. Per esempio:

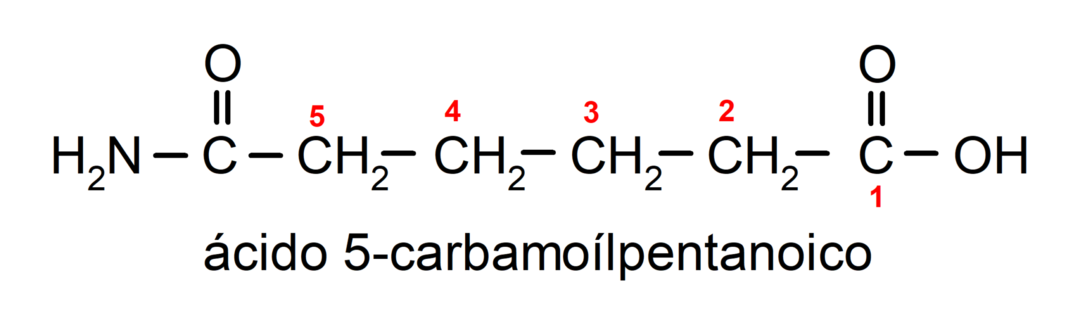
- Le ammidi reagiscono con gli alcali per formare il corrispondente acido carbossilico e un sale carbossilato. Per esempio:
- Le ammidi vengono ridotte ad ammine in presenza di tetraidruro di litio alluminio:
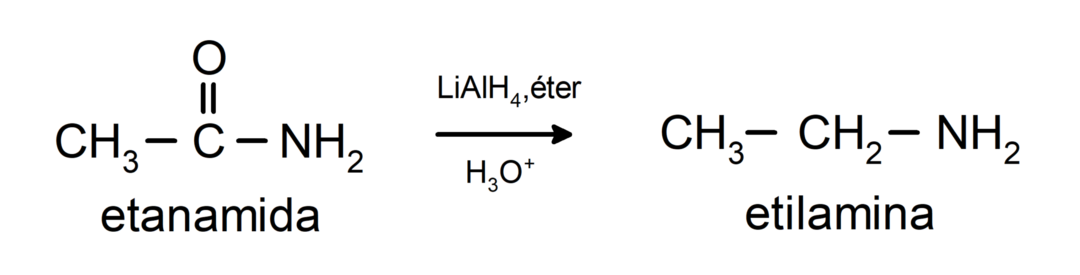
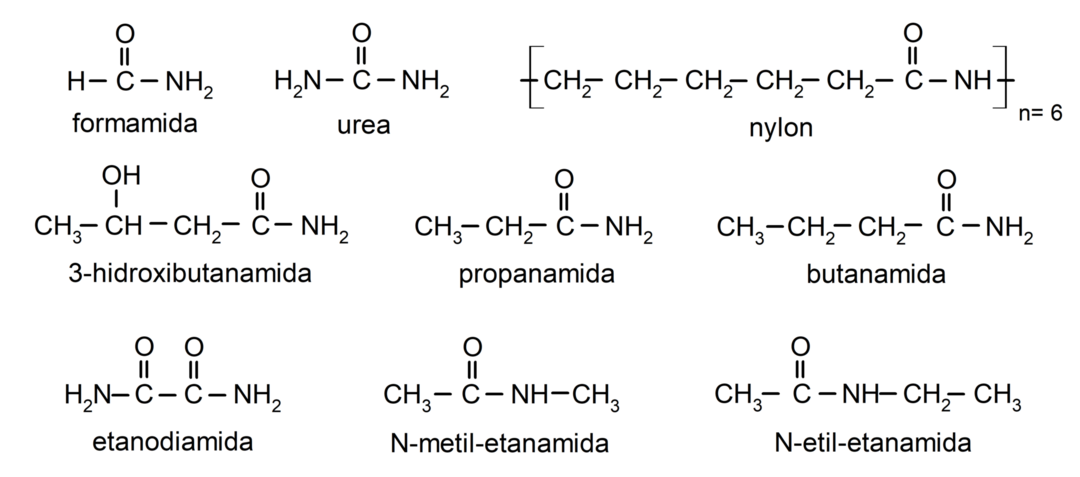
Esempi di ammidi
- formammide
- urea
- nylon
- ε-caprolattame
- etanamide
- propanammide
- butanammide
- etandiammide
- N-metil-etanammide
- N-etile-etanammide
- N-propiletanammide
- N, N-dimetil-butanammide
- benzenecarbossammide
- 4-bromo-3-metil-cicloesancarbossammide
- 3-idrossibutanammide

Usi delle ammidi
Le ammidi sono ampiamente utilizzate nell'industria farmaceutica. Inoltre vengono utilizzati come componenti distaccanti nell'industria delle materie plastiche. D'altra parte, vengono utilizzati come emulsionanti, tensioattivi e solventi. Ad esempio, l'urea è un'ammide ampiamente utilizzata nell'industria farmaceutica e nell'industria del nylon.
Riferimenti
- Ramírez-Barrón, S. N., Sáenz-Galindo, A., López-López, L., & Cantú-Sifuentes, L. (2013). Ammidi, applicazione e sintesi. Rivista scientifica dell'Università Autonoma di Coahuila, 5(9).
- Cagliari, S. C. e Pagnan, M. (2013). Studio teorico sull'idrolisi acida di ammidi alifatiche ed aromatiche. Informazioni tecnologiche, 24(3), 35-40.
- Martinez, C. H. M., Gomez, L. E. P., de Escobar, M. S., & Escalante, F. A. (2002). chimica organica. Università di Las Palmas de Gran Canaria, Vicerettorato agli Studi e alla Qualità dell'Insegnamento.
Segui con:
- Aldeidi
- Alcoli
- Macronutrienti e micronutrienti
- Composti organici ed inorganici