20 esempi di ammine
Esempi / / November 06, 2023
IL ammine Sono composti chimici organici derivati dell'ammoniaca (NH3), dove almeno uno degli idrogeni dell'ammoniaca è stato sostituito da un gruppo alchilico o arilico, dando luogo alla formazione di un gruppo amminico (-NH2, -NH-, -N=). Per esempio:metilammina, etilammina e propilammina.

Un gruppo alchilico è un sostituente che si forma quando un idrogeno viene rimosso da un idrocarburo saturo. In questo modo il carbonio da cui è stato separato l’idrogeno può legarsi ad un altro atomo. Ad esempio: metile (CH3 -) ed etile (CH3 – CH2 -).
Un gruppo arilico è un sostituente derivato da un anello aromatico, come il benzene. Ad esempio: fenile (C6H5 -)
- Vedi anche: Ammidi
Tipi di ammine
Le ammine possono essere classificate in base al numero di atomi di idrogeno legati all'azoto che sono stati sostituiti da gruppi funzionali alchilici o arilici.
Secondo questo criterio si distinguono:
- ammine primarie. Si formano quando solo uno degli atomi di idrogeno dell'ammoniaca viene sostituito da un gruppo alchilico o arilico. Per esempio: etilammina e 1-pentilammina.
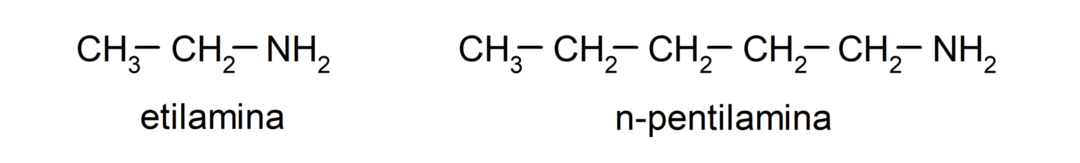
- ammine secondarie. Si formano quando due degli atomi di idrogeno dell'ammoniaca vengono sostituiti da un gruppo alchilico o arilico. Per esempio: dietilammina ed etilmetilammina.
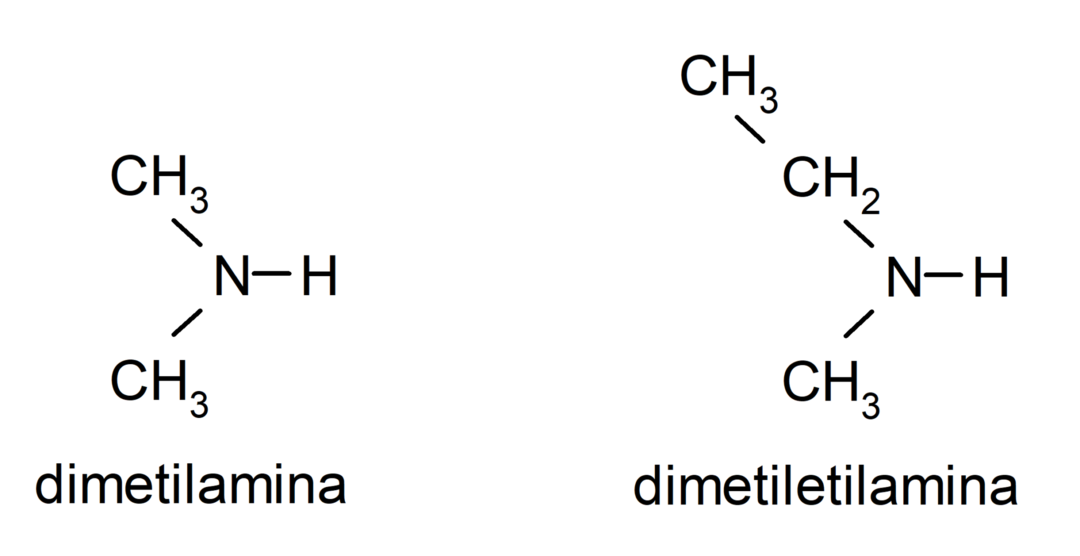
- Ammine terziarie. Si formano quando i tre atomi di idrogeno dell'ammoniaca vengono sostituiti da un gruppo alchilico o arilico. Per esempio: trimetilammina e dimetiletilammina.
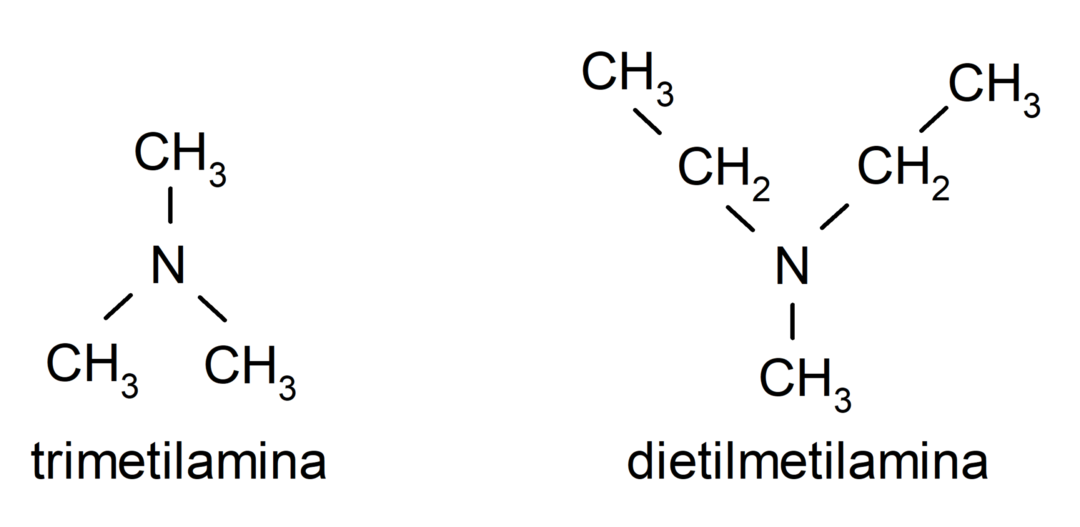
Le ammine vengono classificate anche in base al tipo di gruppo attaccato all'azoto. Secondo questo criterio si distinguono:
- Ammine alifatiche. Hanno sostituenti alchilici. Per esempio: butilammina e dietilammina.

- ammine aromatiche. Hanno sostituenti arilici. Per esempio: fenilammina (anilina) e difenilammina.
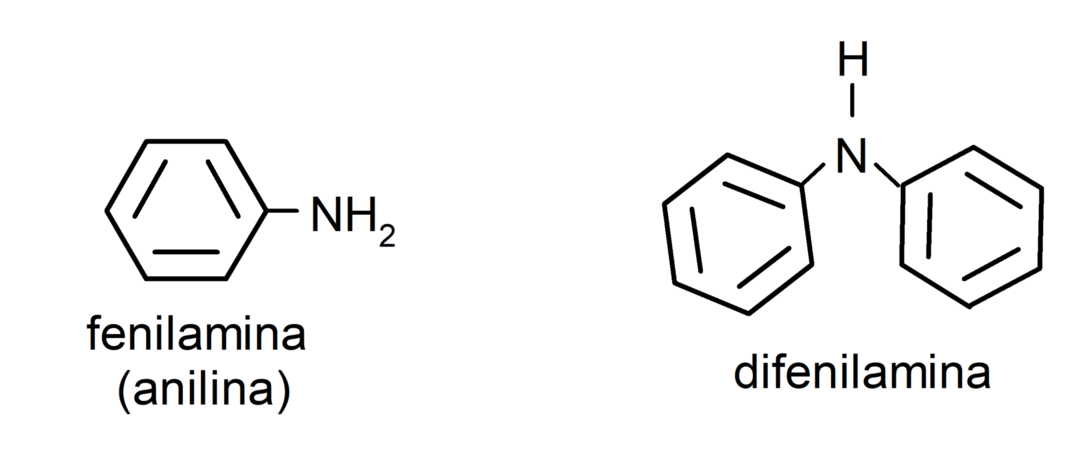
Nomenclatura delle ammine
Secondo la IUPAC (Unione Internazionale di Chimica Pura e Applicata), le ammine vengono denominate seguendo le seguenti regole:
Per le ammine più semplici viene nominato ciascuno dei sostituenti dei gruppi idrogeno legati all'azoto ammoniacale. Quindi la parola "ammina" viene posta alla fine del nome.
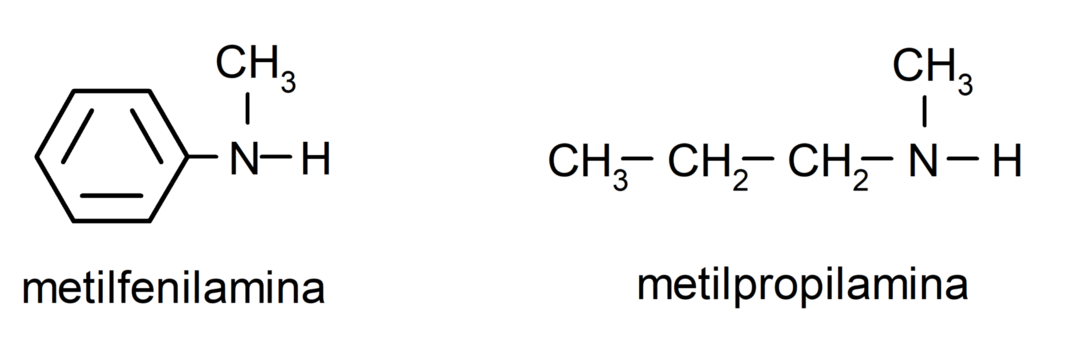
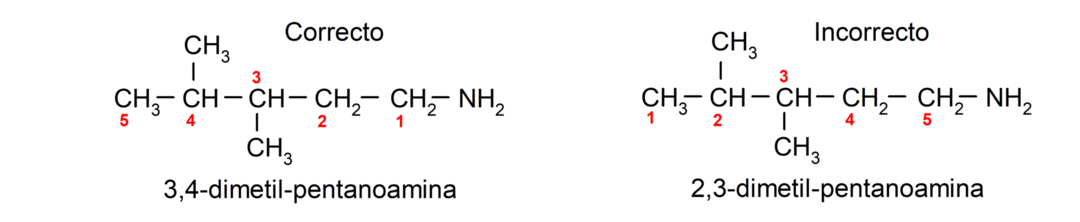
Per le ammine che contengono più catene di carbonio (che, a loro volta, hanno altri sostituenti), la catena di carbonio che contiene il gruppo amminico viene scelta come principale. Inoltre, la posizione del gruppo amminico viene scelta in modo tale che occupi la posizione più piccola nella catena del carbonio, e in In base a questa posizione, anche i sostituenti vengono scelti in modo che occupino la posizione più piccola possibile nella catena.
Infine, vengono denominati utilizzando il nome dell'alcano, alchene o alchino corrispondente per la catena principale, e viene inserito il suffisso amminico.
Se la catena del carbonio contiene più gruppi amminici, questi vengono scelti nella posizione che occupano nella combinazione più piccola della numerazione delle loro posizioni. Inoltre viene posto il nome del corrispondente alcano, alchene o alchino, seguito dal termine che indica il numero di gruppi amminici, seguito dal suffisso “ammina”.

Proprietà fisiche delle ammine
Le proprietà fisiche delle ammine dipendono in gran parte da quanti idrogeni attaccati all'azoto sono stati sostituiti e da che tipo di sostituenti sono stati sostituiti.
- Solubilità. In generale le ammine sono più solubili in acqua dei corrispondenti idrocarburi saturi. Inoltre, le ammine con lunghe catene di carbonio sono meno solubili in acqua rispetto alle ammine con catene di carbonio corte. D'altra parte, le ammine aromatiche non sono solubili in acqua.
- Punto di ebollizione. Il punto di ebollizione delle ammine è superiore a quello degli alcani con lo stesso numero di atomi di carbonio.
- Odore. La maggior parte delle ammine hanno odori sgradevoli. Ad esempio, la putrescina odora di carne in decomposizione e la trimetilammina odora di pesce in decomposizione.
Proprietà chimiche delle ammine
Alcune proprietà chimiche delle ammine sono:
- Sono composti chimici di base, cioè subiscono reazioni in cui accettano protoni secondo la teoria di Brønsted-Lowry. Per esempio:
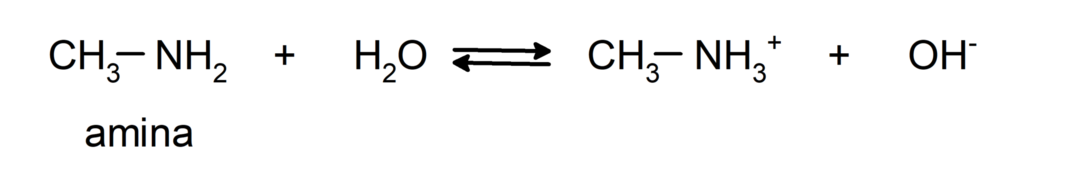
- Presentano reazioni di neutralizzazione con acidi in cui si formano sali amminici. Per esempio:

Esempi di ammine
- metilammina
- etilammina
- propilammina
- dimetilammina
- etilmetilammina
- fenilammina (anilina)
- difenilammina
- metilpropilammina
- butano-1,4-diammina
- spermina
- cadaverina
- 3,5-dimetilanilina
- metilanilina
- anfetamina
- piperazina


Funzione biologica delle ammine
Le ammine sono presenti in molti esseri viventi ed eseguire varie funzioni. Alcune ammine, come l’adrenalina, la norepinefrina, la serotonina e la dopamina, sono neurotrasmettitori.
Il gruppo amminico è uno dei gruppi funzionali che formano gli amminoacidi, che ne sono le unità fondamentali proteine. Inoltre, le basi azotate che compongono il DNA e l'RNA contengono gruppi amminici.
Usi delle ammine
Alcuni usi delle ammine sono:
- Sono utilizzati per produrre composti agrochimici e farmaceutici.
- Sono utilizzati come catalizzatori nella produzione di poliuretani.
- Grazie al loro effetto smorzante, vengono utilizzati per inibire la corrosione in ambienti acquosi.
- Sono utilizzati per purificare i gas nelle centrali elettriche e nelle raffinerie.
- Vengono utilizzati per realizzare prodotti per la pulizia.
- Vengono utilizzati per produrre prodotti per la cura personale, poiché migliorano la formazione di schiuma nei saponi e negli shampoo.
Tossicità delle ammine
L'inalazione di ammine in alte concentrazioni provoca avvelenamento, che a sua volta provoca aumento della pressione sanguigna e convulsioni. Inoltre, il contatto con le ammine alifatiche in stato gassoso provoca irritazione agli occhi e alle vie respiratorie. Diverse ammine causano ustioni alla pelle al contatto.
Le ammine aromatiche sono molto tossiche, ma poiché sono molto meno volatili delle ammine alifatiche, il contatto con esse può essere controllato meglio.
Riferimenti
- Perez, C. R. C., & Jiménez-Colmenero, F. (2010). Ammine biogene: importanza tossicologica. Elettrone. J. Biomed., 3, 58-60.
- Fernández García, M., & Álvarez González, M. Á. (2005). Ammine biogene negli alimenti.
Segui con:
- Alcoli
- Aldeidi
- Alcol etilico
- chimica organica


