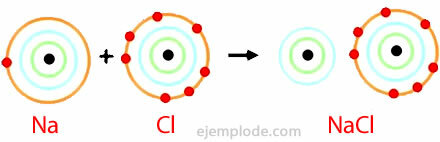
Esempio di legame ionico
Chimica / / July 04, 2021
Il legame ionico è dato dalla presenza di un catione e di un anione, specie chimiche con cariche elettriche di segno opposto. È definita come la forza elettrostatica che lega gli ioni in un composto ionico.
Gli atomi di elementi con basse energie di ionizzazione tendono a formare cationi. Al contrario, quelli con elevata affinità elettronica tendono a formare anioni.
I metalli alcalini e alcalino-terrosi hanno maggiori probabilità di formare cationi nei composti ionici e gli alogeni e l'ossigeno hanno maggiori probabilità di formare anioni. Di conseguenza, la composizione di una grande varietà di composti ionici risulta dalla combinazione di un metallo del gruppo IA o IIA e un alogeno o ossigeno.
Ad esempio, la reazione tra litio e fluoro produce fluoruro di litio, una polvere bianca velenosa utilizzata per abbassare il punto di fusione della saldatura e nella produzione di ceramiche. La configurazione elettronica del litio è 1s2, 2s1, e quello del fluoro è 1s2, 2s2, 2 P5. Quando questi atomi entrano in contatto, l'elettrone di valenza 2s1 Il litio viene trasferito all'atomo di fluoro.
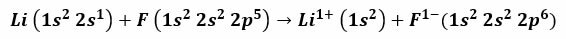
È valido ipotizzare che la procedura inizi con il distacco dell'elettrone litio, ionizzandolo per raggiungere la valenza positiva 1+. Continua con la ricezione di questo elettrone da parte del Fluoro, che gli conferisce una carica negativa. Alla fine, la formazione del legame ionico avviene per attrazione elettrostatica. Il composto di fluoruro di litio sarà elettricamente neutro.
Molte reazioni comuni portano alla formazione di legami ionici. Ad esempio, la combustione del calcio in ossigeno produce ossido di calcio:
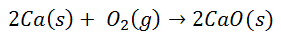
La molecola di ossigeno biatomico si separa in due singoli atomi. Quindi ci sarà un trasferimento di due elettroni dall'atomo di calcio a ciascun atomo di ossigeno. Entrambi avranno quindi le rispettive cariche: per il Calcio 2+ per ogni atomo, e per l'Ossigeno 2- per ogni atomo. Dopo il legame finale, la molecola di ossido di calcio è elettricamente neutra.
Energia reticolare dei composti ionici
Con i valori di energia di ionizzazione e di affinità elettronica degli elementi è possibile prevedere cosa elementi formano composti ionici, ma è necessario valutare anche la stabilità di questo tipo di composti.
L'energia di ionizzazione e l'affinità elettronica sono definite per i processi che avvengono in fase gassosa, sebbene tutti i composti ionici siano solidi a 1 atmosfera di pressione e 25 ° C. Lo stato solido è una condizione molto diversa perché ogni catione è circondato da un determinato numero di anioni e viceversa. Di conseguenza, la stabilità complessiva del composto ionico solido dipende dalle interazioni di tutti gli ioni e non solo dall'interazione di un catione con un anione.
Una misura quantitativa della stabilità di qualsiasi solido ionico è il suo energia reticolare, che è definito come L'energia necessaria per separare completamente una mole di un composto ionico solido nei suoi ioni allo stato gassoso.
Ciclo di Born-Haber per determinare l'energia reticolare
Non è possibile misurare direttamente l'energia del reticolo. Tuttavia, se si conoscono la struttura e la composizione di un composto ionico, è possibile calcolare la sua energia reticolare applicando la legge di Coulomb, che afferma che l'energia potenziale tra due ioni è direttamente proporzionale al prodotto delle loro cariche e inversamente proporzionale alla distanza tra loro. Fermare.
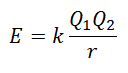
Poiché la carica del Catone è positiva e quella dell'Anione è Negativa, il prodotto darà un risultato negativo in Energia. Questo rappresenta una reazione esotermica. Di conseguenza, per invertire il processo, è necessario fornire energia.
È anche possibile determinare indirettamente l'energia del reticolo se si presume che un composto ionico si formi in più fasi. Questa procedura è nota come Ciclo di Born-Haber, che mette in relazione le energie reticolari dei composti ionici con le energie di ionizzazione, l'affinità elettronica e altre proprietà atomiche e molecolari. Questo metodo si basa sulla legge della somma algebrica delle reazioni chimiche di Hess ed è stato sviluppato da Max Born e Fritz Haber. Il ciclo Born-Haber definisce le diverse fasi che precedono la formazione di un solido ionico.

Cloruro di sodio
Il cloruro di sodio è un composto ionico con un punto di fusione di 801°C, che conduce elettricità allo stato fuso e in soluzione acquosa. Il salgemma è una delle fonti di cloruro di sodio e si trova in depositi sotterranei spesso spessi diverse centinaia di metri. Il cloruro di sodio si ottiene anche dall'acqua di mare o dalla salamoia (una soluzione concentrata di NaCl) per evaporazione solare. Inoltre, si trova in natura nel minerale chiamato Halite.

Il cloruro di sodio viene utilizzato più di qualsiasi altro materiale nella produzione di composti chimici inorganici. Il consumo mondiale di questa sostanza è di circa 150 milioni di tonnellate all'anno. Il cloruro di sodio viene utilizzato principalmente nella produzione di altri composti chimici inorganici, come gas di cloro, idrossido di sodio, sodio metallico, gas idrogeno e carbonato di sodio. Viene anche usato per sciogliere ghiaccio e neve su autostrade e strade.