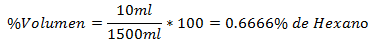Esempio di concentrazione: molarità, molalità, normalità e percentuale
Chimica / / July 04, 2021
Il Concentrazione è definito come Quantità o proporzione di una certa sostanza, presente in una soluzione. La soluzione è un miscela omogenea homogeneous (monofase visibile) che può essere solido, liquido o gassoso, quindi la concentrazione può essere espressa in modi diversi.
È necessario definire che una Soluzione contiene due componenti principali: Soluto e Solvente, e in generale, la concentrazione si concentra sull'espressione di quanto soluto è mescolato nell'intera soluzione. comunque, il La concentrazione può esprimere la quantità o la proporzione di ciascuno di essi.
Espressione di concentrazione
In Chimica, la quantità di sostanza presente in una soluzione può essere espressa in diversi modi: Molarità, Molalità, Normalità, Percentuale in peso, Percentuale in volume.
Di queste cinque unità, tutte possono essere applicate a soluzioni solide, liquide e gassose. Ma Molality, ad esempio, è quella più utilizzata per soluzioni solide.
Esempi di molarità
Il La molarità indica quante moli di sostanza ci sono in ogni Litro di Soluzione Completa
. È l'unità più utilizzata in chimica per soluzioni liquide, quando si esegue l'analisi volumetrica. È indicato dalla lettera "M".Conoscendo i grammi di soluto, si dividono per il peso molecolare del soluto. Si ottengono così le Mole di Soluto presenti nella Soluzione.
Quindi, le Mole di Soluto vengono divise per i Litri di Soluzione, e così si ottengono le unità di Molarità: Mole di Soluto / Litro di Dissoluzione.
1.- Per una soluzione di 0,5 litri di Idrossido di Magnesio [Mg (OH)2], e se il Peso Molecolare dell'Idrossido di Magnesio è 58 g/mol. Ne hai 36 grammi.
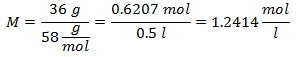
2.- Per una soluzione da 1 litro di idrossido di calcio [Ca (OH)2], e se il Peso Molecolare dell'Idrossido di Calcio è 74 g/mol. Ne hai 42 grammi.

3.- Per una soluzione di 3 litri di Cloruro di Sodio (NaCl), e se il Peso Molecolare del Cloruro di Sodio è 58 g/mol. Ne hai 28 grammi.
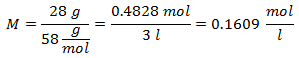
4.- Per una soluzione di 5 litri di Cloruro di Calcio (CaCl2), e se il Peso Molecolare del Cloruro di Calcio è 110 g/mol. Ne hai 13 grammi.
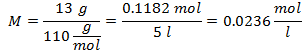
5.- Per una soluzione di 10 litri di Sodio Solfato (Na2SW4), e se il Peso Molecolare del Solfato di Sodio è 142 g/mol. Ne hai 96 grammi.
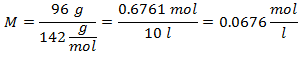
Esempi di Molalità
Il La molalità indica quante moli di Soluto ci sono per 1000 grammi di Solvente nella Soluzione. È l'unità più utilizzata in chimica per soluzioni solide. È indicato dalla lettera "m".
Conoscendo i grammi di soluto, si dividono per il peso molecolare del soluto. Si ottengono così le Mole di Soluto presenti nella Soluzione.
Quindi, le Moli di Soluto vengono regolate per ogni 1000 grammi di Soluzione, che vengono stabiliti come base di calcolo, e quindi si ottengono le unità di molalità: Moles of Soluto / 1000g of Solvente
1.- Per una soluzione con 1000 g di Solvente minerale e 36 grammi di Idrossido di Magnesio [Mg (OH)2], e se il Peso Molecolare dell'Idrossido di Magnesio è 58 g/mol.

2.- Per una soluzione di 2000 g di solvente minerale e 42 grammi di idrossido di calcio [Ca (OH)2], e se il Peso Molecolare dell'Idrossido di Calcio è 74 g/mol.
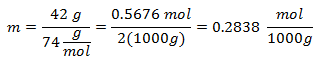
3.- Per una soluzione di 3000 g di solvente minerale e 28 grammi di cloruro di sodio (NaCl), e se il peso molecolare del cloruro di sodio è 58 g / mol.
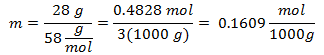
4.- Per una soluzione di 5000g di Solvente minerale e 13 grammi di Cloruro di Calcio (CaCl2), e se il Peso Molecolare del Cloruro di Calcio è 110 g/mol.
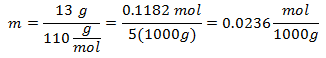
5.- Per una soluzione di 10.000 g di solvente minerale e 96 grammi di solfato di sodio (Na2SW4), e se il Peso Molecolare del Solfato di Sodio è 142 g/mol.
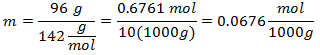
Le quantità di solvente vengono gestite come multipli di 1000 g, per lasciare 1000 grammi come riferimento e non includerli, influenzando il calcolo.
Esempi di normalità
Il La normalità indica quante sostanze equivalenti ci sono in ogni litro di soluzione completa. La normalità è l'altra unità più utilizzata in chimica per soluzioni liquide, quando si esegue l'analisi volumetrica. È indicato dalla lettera "N".
Un equivalente è un'unità che risulta dalla divisione dei grammi del soluto (g) per il suo peso equivalente (piccolo). Il Peso Equivalente (Peq) risulta dalla divisione del Peso Molecolare (PM) per il Valencia attivo (*), che è più facile da osservare in Acidi e Basi. Ad esempio, il Valencia attivo dell'acido cloridrico (HCl) è 1; il Valencia attivo di idrossido di calcio [Ca (OH)2] è 2, a causa degli ioni Idrogeno (H+) e Idrossile (OH-) che ciascuno presenta.
Quindi, gli Equivalenti Soluti vengono divisi per i Litri Soluzione, e così si ottengono le unità di Normalità: Equivalenti Soluti / Litri Soluzione.
1.- Per una soluzione di 0,5 litri di Idrossido di Magnesio [Mg (OH)2], e se il Peso Molecolare dell'Idrossido di Magnesio è 58 g/mol. Ne hai 36 grammi.
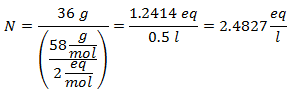
2.- Per una soluzione da 1 litro di idrossido di calcio [Ca (OH)2], e se il Peso Molecolare dell'Idrossido di Calcio è 74 g/mol. Ne hai 42 grammi.
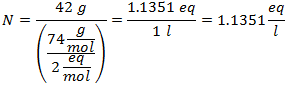
3.- Per una soluzione di 3 litri di Cloruro di Sodio (NaCl), e se il Peso Molecolare del Cloruro di Sodio è 58 g/mol. Ne hai 28 grammi.
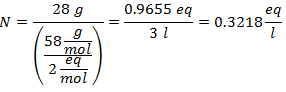
4.- Per una soluzione di 5 litri di Cloruro di Calcio (CaCl2), e se il Peso Molecolare del Cloruro di Calcio è 110 g/mol. Ne hai 13 grammi.
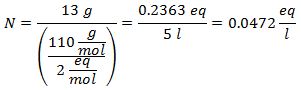
5.- Per una soluzione di 10 litri di Sodio Solfato (Na2SW4), e se il Peso Molecolare del Solfato di Sodio è 142 g/mol. Ne hai 96 grammi.
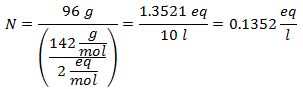
Esempi di percentuale in peso
Il Percentuale in peso è un'espressione della Concentrazione che risulta dalla divisione del Quantità in grammi di Soluto tra grammi di Soluzione Totale. Ottenendo una quantità decimale, si moltiplica per 100 e si esprime con il simbolo "%". Questa unità viene generalmente utilizzata per misurare le concentrazioni in miscele solide o granulari.
1.- Una miscela di 1300 g totali contiene 13 g di carbonato di calcio. La percentuale in peso è:
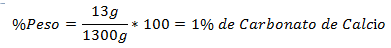
2.- Una miscela di 100 g totali contiene 26 g di zucchero. La percentuale in peso è:
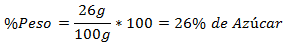
3.- Una miscela di 250 g totali contiene 60 g di cloruro di sodio. La percentuale in peso è:
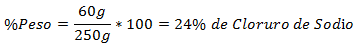
4.- Una miscela di 800 g totali contiene 150 g di idrossido di calcio. La percentuale in peso è:
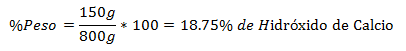
5.- Una miscela di 1500 g totali contiene 10 g di bicarbonato di sodio. La percentuale in peso è:
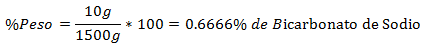
Esempi di percentuale di volume
Il Percentuale in volume è un'espressione della Concentrazione che risulta dalla divisione del quantità in unità di Volume del Soluto diviso per il Volume della Soluzione Totale. Ottenendo una quantità decimale, si moltiplica per 100 e si esprime con il simbolo "%". Questa unità viene generalmente utilizzata per misurare le concentrazioni in miscele di componenti liquidi o gassosi.
1.- Una miscela di 1300 ml in totale contiene 130 ml di etanolo. La percentuale del volume è:
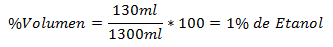
2.- Una miscela di 100 ml in totale contiene 26 ml di glicerina. La percentuale del volume è:
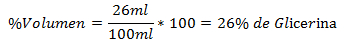
3.- Una miscela di 250 ml in totale contiene 60 ml di etere etilico. La percentuale del volume è:
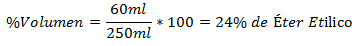
4.- Una miscela di 800 ml in totale contiene 150 ml di glicole. La percentuale del volume è:
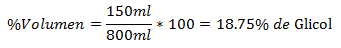
5.- Una miscela di 1500 ml in totale contiene 10 ml di esano. La percentuale del volume è: