Esempio della legge di Carlo
Fisica / / July 04, 2021
La legge del gas di Charles o legge della pressione costante, è un'altra delle leggi del gas, enunciato da Gay-Lussac, che pubblicò l'opera di Jacques Charles, pubblicata intorno al 20 anni prima.
La legge di Charles prevede il comportamento di una massa di gas quando la pressione rimane costante e la temperatura e il volume variano.
La legge di Carlo è enunciata come segue:
A pressione costante, il volume di un gas è direttamente proporzionale alla variazione della sua temperatura.
Pressione costante: si riferisce al fatto che la pressione che il gas esercita sulle pareti del contenitore non varierà durante l'esperienza.
Volume: è lo spazio occupato che occupa il gas, in genere è considerato un contenitore con pareti che non si deformano, e il cui coperchio funziona come uno stantuffo.
Temperatura: È l'aumento o la perdita di calore che subisce il gas durante la sperimentazione. Se la temperatura aumenta, il volume aumenta. Se la temperatura diminuisce, diminuisce anche il volume.
Algebricamente, la legge di Charles si esprime con la seguente formula:

Dove:
V = volume di gas
T = temperatura del gas
k = costante di proporzionalità per quella massa di gas.
Ciò significa che per una data massa di gas, a pressione costante, il rapporto tra il volume e la variazioni di temperatura, avranno sempre lo stesso rapporto di proporzionalità, rappresentato dalla costante K:

Quindi, una volta determinata la costante, possiamo calcolare uno qualsiasi degli altri valori dagli altri dati noti:
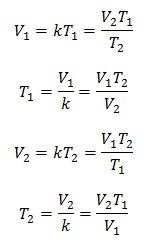
3 Esempi di legge di Charles applicata ai problemi:
Esempio 1: Calcolare il nuovo volume, se in un recipiente è presente una massa di gas che occupa un volume di 1,3 litri, ad una temperatura di 280 K. Calcolare il volume quando si raggiunge una temperatura di 303 K.
V1 = 1,3 litri.
T1 = 280 K
V2 = ?
T2 = 303 K
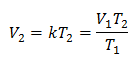
Valori sostitutivi:
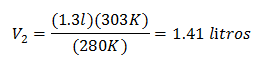
Il nuovo volume a 303 K è di 1,41 litri.
Esempio 2. Se abbiamo un gas che occupa 2,4 litri a 10 gradi Celsius, calcoliamo la temperatura finale, se alla fine occupa 2,15 litri.
V1 = 2,4 l
T1 = 10°C = 283 K
V2 = 2,15 l
T2 = ?
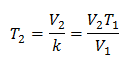
Valori sostitutivi:
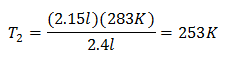
La nuova temperatura è 253 K, che è pari a -20 ° C.
Esempio 3. Abbiamo un gas la cui temperatura iniziale è 328 K, il suo volume finale è 3,75 l e la sua costante di rapporto è 0,00885.
V1 = ?
T1 = 328 K
V2 = 3,75 l
T2 = ?
k = 0,00885
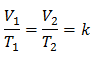
Valori sostitutivi:
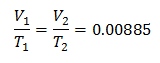
Per conoscere il volume iniziale:
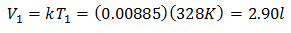
Il volume iniziale è di 2,90 l.
Per conoscere la temperatura finale:
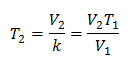
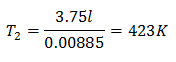
La temperatura finale sarà di 423 K, che è pari a 150 ° C.

