דוגמה לחוק צ'ארלס
פיזיקה / / November 13, 2021
חוק הגז של צ'ארלס או חוק הלחץ הקבוע, הוא עוד אחד מחוקי הגז, הוצהר על ידי גיי-לוסאק, שפרסם את עבודתו של ז'אק צ'ארלס, שפורסם בסביבות ה-20 שנים לפני כן.
חוק צ'ארלס חוזה את ההתנהגות של מסת גז כאשר הלחץ נשאר קבוע והטמפרטורה והנפח משתנים.
חוק צ'ארלס נאמר כך:
בלחץ קבוע, נפח הגז עומד ביחס ישר לשינוי בטמפרטורה שלו.
לחץ מתמיד: מתייחס לעובדה שהלחץ שהגז מפעיל על דפנות המיכל לא ישתנה לאורך החוויה.
כרך: זה המקום התפוס שהגז תופס, באופן כללי הוא נחשב למיכל בעל קירות שאינם מתעוותים, והמכסה שלו פועל כמו בוכנה.
טֶמפֶּרָטוּרָה: זוהי העלייה או איבוד החום שהגז עובר במהלך הניסוי. אם הטמפרטורה עולה, הנפח גדל. אם הטמפרטורה יורדת, גם הווליום יורד.
מבחינה אלגברית, חוק צ'ארלס מבוטא בנוסחה הבאה:

איפה:
V = נפח גז
T = טמפרטורת הגז
k = קבוע מידתיות עבור אותה מסה של גז.
המשמעות היא שעבור מסה נתונה של גז, בלחץ קבוע, הקשר בין הנפח ל- שינויים בטמפרטורה, תמיד יהיו בעלי אותו קשר מידתיות, המיוצג על ידי הקבוע ק:

אז ברגע שהקבוע נקבע, נוכל לחשב כל אחד מהערכים האחרים מהנתונים הידועים האחרים:
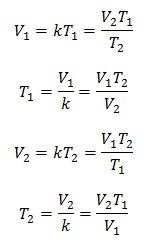
3 דוגמאות לחוק צ'ארלס שהוחל על בעיות:
דוגמה 1: חשב את הנפח החדש, אם במיכל יש מסה של גז שתופסת נפח של 1.3 ליטר, בטמפרטורה של 280 K. חשב את הנפח כאשר מגיעים לטמפרטורה של 303 K.
V1 = 1.3 ליטר.
ט1 = 280 K
V2 = ?
ט2 = 303 K
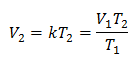
החלפת ערכים:
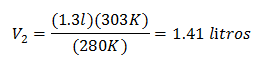
הנפח החדש ב-303 K הוא 1.41 ליטר.
דוגמה 2. אם יש לנו גז שתופס 2.4 ליטר ב-10 מעלות צלזיוס, חשב את הטמפרטורה הסופית, אם בסוף הוא תופס 2.15 ליטר.
V1 = 2.4 ליטר
ט1 = 10 מעלות צלזיוס = 283 K
V2 = 2.15 ליטר
ט2 = ?
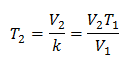
החלפת ערכים:
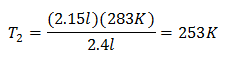
הטמפרטורה החדשה היא 253 K, השווה ל-20 מעלות צלזיוס.
דוגמה 3. יש לנו גז שהטמפרטורה ההתחלתית שלו היא 328 K, הנפח הסופי שלו הוא 3.75 ליטר, וקבוע היחס שלו הוא 0.00885.
V1 = ?
ט1 = 328 K
V2 = 3.75 ליטר
ט2 = ?
k = 0.00885
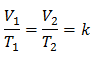
החלפת ערכים:
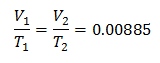
כדי לדעת את הכרך הראשוני:
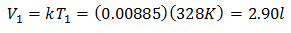
הנפח הראשוני הוא 2.90 ליטר.
כדי לדעת את הטמפרטורה הסופית:
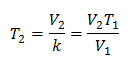
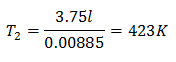
הטמפרטורה הסופית תהיה 423 K, השווה ל-150 מעלות צלזיוס.


