הגדרה של גיאומטריה מולקולרית
Miscellanea / / January 11, 2022
הגדרה מושגית
המבנה של מולקולה הוא שקובע את הסידור התלת מימדי של האטומים המרכיבים אותה בחלל.

מהנדס כימי
גיאומטריות מולקולריות מוגדרות כיום על סמך ה תֵאוֹרִיָה של דחיית זוגות אלקטרוניים של שכבת ולנסיה (TRPECV). תיאוריה זו מאפשרת לחזות את ההתנהגות כִּימִי של חומרים (במיוחד קוולנטי) ועוזר להבין את הפצה אלקטרוניקה, המובילה ל גֵאוֹמֶטרִיָה של ה מולקולה. זה, בתורו, מאפשר לנו להבין רבות מהתכונות שחומרים רוכשים.
תיאוריה זו מבוססת על שורה של עמודי יסוד שאותם נסקור ולאחר מכן ננסה להבין אותם יישום תרגול. מלכתחילה, אלקטרונים קשורים ולא קשורים (ערכיות) נחשבים כים של אלקטרונים שעל ידי בעלי אותו סוג של מטען, הם דוחים זה את זה, כך שהם תמיד יהיו ממוקמים רחוק מהאטום המרכזי של מולקולה.
שנית, "ים" זה של אלקטרונים או "ענן אלקטרוני" יוצר אזורים בעלי צפיפות אלקטרונים גבוהה, המורכבים בקשרים, שבהם האלקטרונים משותפים או בזוגות אלקטרונים שאינם משותפים. בתורו, הקשרים שנוצרים יכולים להיות בודדים, כפולים או אפילו משולשים.
לבסוף, עבור לְהַחלִיט גיאומטריה מולקולרית, זה מאוד מועיל לקבל את מבנה לואיס, שבו כמות צפיפות האלקטרונים סביב האטום המרכזי תיספר וזה ייתן
סִימָן לפי שם הגיאומטריה שלה והצורה שהמולקולה מקבלת בתלת מימד.יש לציין שצפיפויות אלו ימוקמו כמה שיותר רחוק זו מזו, על מנת לאמץ את המבנה היציב ביותר ובמקום בו יש פחות דחיה. כך, תחילה מזהים את הגיאומטריה האלקטרונית ולאחר מכן את הגיאומטריה המולקולרית.
שש רמות צפיפות
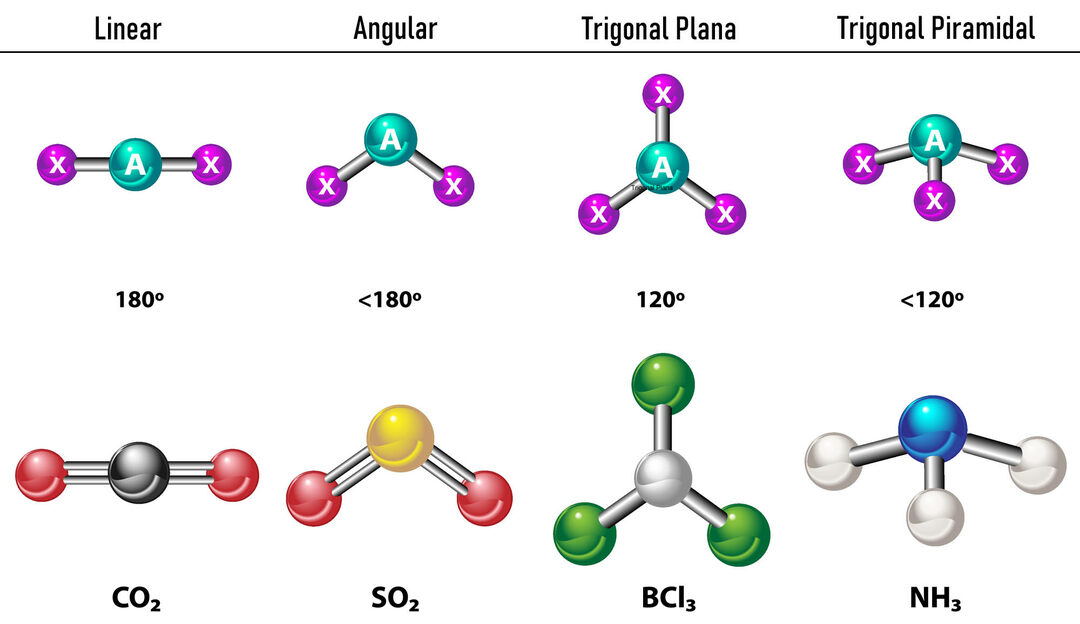
במקרה שישנן שתי צפיפות אלקטרונים סביב האטום המרכזי, הקשרים יהיו ממוקמים רחוק זה מזה ביניהם, כלומר 180º אחד מהשני, ולכן, הגיאומטריה האלקטרונית שלהם היא ליניארית ומבחינה מולקולרית היא גם ליניארית.
במקרה שיש שלוש צפיפות אלקטרונים סביב האטום המרכזי, יש שתי אפשרויות: שלושה קשרים או שני קשרים וזוג אחד לא קשור. אם יש שלושה קשרים, הגיאומטריה האלקטרונית היא שטוח טריגונל, עם זוויות של 120º בין קשרים וגיאומטריה מולקולרית מקבל את אותו השם. עכשיו, אם יש זוג לא קשור, הם דוחים אחד את השני עם יותר עָצמָה שמטענים מלוכדים נוטים אפוא לדחוס זוויות קשר. הזווית בין הזוג החופשי לכל קשר היא 120º והגיאומטריה האלקטרונית היא מישור טריגונל ואילו הגיאומטריה המולקולרית היא זוויתית.
במקרה שיש ארבע צפיפות אלקטרונים סביב האטום המרכזי, הגיאומטריה האלקטרונית היא טטרהדרלית. אם כל ארבעת זוגות האלקטרונים קשורים, הגיאומטריה המולקולרית שלהם עולה בקנה אחד עם הגיאומטריה האלקטרונית שלהם וזווית הקשר היא 109.5º. כעת, אם אחד מהזוגות פנוי, זווית הקשר הולכת וקטנה (107º) והגיאומטריה המולקולרית היא סוג פירמידה טריגונלית. לבסוף, אם שניים הם זוגות חופשיים ושניים קשורים, זווית הקשר היא 104.5º בעוד שהגיאומטריה המולקולרית נקראת זוויתי.
כאשר צפיפות האלקטרונים מסביב לאטום המרכזי מגיעות לחמש, זה נקרא a ביפירמידה טריגונלית הגיאומטריה האלקטרונית שלו. אם כל העומסים מקושרים, קיימות זוויות של 120ºC בין הקישורים הממוקמים בקו המשווני ו-90º בין הציר לאלו המשווני. כעת, גיאומטריה מולקולרית נקראת גם ביפירמידה טריגונלית, בעוד שבעל ארבעה זוגות מקושרים וזוג אחד חופשי, הגיאומטריה המולקולרית מעוותת ויוצרת את "הידוע"כִּסֵא נַדנֵדָה", שם הוא רוכש טטרהדרון מעוות. בעוד שאם שניים מתוך חמשת זוגות האלקטרונים חופשיים ושלושה מהם קשורים, יש לו גיאומטריה בצורת "T" ושמו נובע בדיוק מהמבנה שלו. לבסוף, אם זה הפוך, שלושה זוגות חופשיים ושני מטענים מלוכדים, הגיאומטריה המולקולרית היא ליניארית.
לבסוף, יש שש צפיפות אלקטרונים סביב האטום המרכזי ונוצר אוקטהדרון, ומכאן שמו בגיאומטריה האלקטרונית. באופן דומה, הגיאומטריה המולקולרית נקראת אם כל הזוגות שלה מקושרים. אם יש לך חמישה זוגות מקושרים וזוג אחד פנוי, הגיאומטריה המולקולרית היא פירמידת הבסיס המרובעת. אם יש לך ארבעה זוגות קשורים ושני זוגות חופשיים, הגיאומטריה המולקולרית היא שטוח מרובע.
דמות: טבע מתוק
נושאים בגיאומטריה מולקולרית
