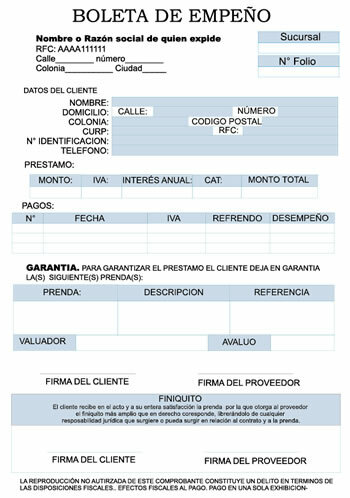
דוגמא לקשר קוולנטי
כִּימִיָה / / July 04, 2021
ה קשר קוולנטי הוא זה שבו שני אטומים מתאחדים על ידי שיתוף האלקטרונים שלהם, ללכת להשלים את כללי האוקטט שלה.
היסטוריה של הקשר הקוולנטי
בתחילת המאה ה -20 החלו כימאים להבין כיצד ומדוע נוצרות מולקולות. פריצת הדרך הגדולה הראשונה הגיעה עם ההצעה של גילברט לואיס לגבי מה היווצרות של קשר כימי מרמז ש אטומים חולקים אלקטרונים. לואיס תיאר את היווצרות הקשר הכימי במימן כ:
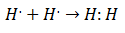
סוג זה של זיווג אלקטרונים הוא דוגמה לקשר קוולנטי, קשר בו שני אלקטרונים משותפים לשני אטומים. ה תרכובות קוולנטיות הם זה מכילים רק קשרים קוולנטיים.
אלקטרונים בקשר קוולנטי
לפשטות, ה זוג אלקטרונים משותף מיוצג לעתים קרובות כ- שורה בודדת חיבור סמלי האלמנטים. לפיכך, הקשר הקוולנטי של מולקולת המימן כתוב כ- H-H.
בקשר קוולנטי, כל אלקטרון של הזוג המשותף נמשך לגרעינים של שני האטומים. אטרקציה זו מחזיקה את שני האטומים במולקולת H יחד.2 והיא אחראית להיווצרות קשרים קוולנטיים במולקולות אחרות.
בקשרים קוולנטיים בין אטומים של כמה אלקטרונים רק אלקטרוני ערכיות משתתפים, שהם החיצוניים ביותר, במסלול הרדוד ביותר. בין אחד לשלושה מהם ישתתפו באיחוד.
האלקטרונים האחרים, שאינם משתתפים בקשר, נקראים
אלקטרונים שאינם קשורים, או אם אנו מארגנים אותם בזוגות, זוגות חינם. כלומר, זוגות אלקטרונים של ולנסיה זה אין להשתתף בהקמת אג"ח קוולנטית.ייצוג אג"ח קוולנטי
המבנים איתם מיוצגים תרכובות קוולנטיות, כגון H2 ו- F2 ידועים בשם מבנים של לואיס. מבנה לואיס הוא ייצוג של קשר קוולנטי, שם צמד האלקטרונים המשותפים מסומן על ידי קווים או כזוגות נקודות בין שני אטומים, וזוגות חופשיים שלא חולקו מסומנים כזוגות נקודות על האטומים האישיים. במבנה לואיס, רק אלקטרוני הערכיות מוצגים, ולא אלה הפנימיים.
בהתחשב במבנה לואיס עבור מולקולת המים H2לחלופין, כל אלקטרוני הערכיות של אטומי המימן והחמצן מסומנים תחילה בנקודות.
במקרה שני, הקישור מסומן בשורה. והזוגות החופשיים, שקיימים רק בחמצן, עם נקודות.
שלטון האוקטט
היווצרות מולקולות אלה, כמו אלה של מים H2לחלופין, הדגימי את השיחה חוק האוקטט, המוצע על ידי לואיס: אטום שאינו מימן נוטה ליצור קשרים עד שהוא מקיף את עצמו עם שמונה אלקטרוני ערכיותכלומר נוצר קשר קוולנטי כאשר אין מספיק אלקטרונים לכל אטום בודד כדי להשלים את האוקטט שלו.
על ידי שיתוף אלקטרונים בקשר קוולנטי, כל אטום משלים את האוקטט שלו. עבור מימן, הדרישה היא שתקבל את התצורה האלקטרונית של הליום, שהיא בסך הכל שני אלקטרונים.
כלל האוקטט פועל בעיקר עבור רכיבי התקופה השנייה או השורה בטבלה המחזורית. לאלמנטים אלה יש גבהות משנה בהן יכולים להיות בסך הכל שמונה אלקטרונים.
כאשר אטום של יסודות אלה יוצר תרכובת קוולנטית, הוא משיג את התצורה האלקטרונית של הגז האצילי ניאון, תוך שיתוף אלקטרונים עם אטומים אחרים באותה תרכובת.
סוגי אג"ח קוולנטיות
אטומים יכולים ליצור סוגים שונים של אג"ח קוולנטיות: רווקים, זוגות או שלשות.
ב קישור פשוט, שני אטומים מחוברים באמצעות זוג אלקטרונים. הם מופיעים ברוב המכריע של תרכובות קוולנטיות, והיא הצורה הבסיסית ביותר של קשר זה.
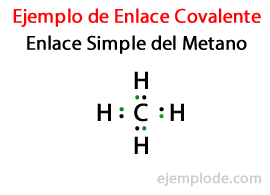
בתרכובות רבות, קישורים כפוליםכלומר כששני אטומים מתחלקים שני זוגות אלקטרונים. אם שני אטומים חולקים שני זוגות אלקטרונים, הקשר הקוולנטי נקרא קשר כפול. קשרים אלה נמצאים במולקולות כמו פחמן דו חמצני (CO2) ואתילן (ג2ה4).

א קישור משולש מתעורר כששני אטומים מתחלקים שלושה זוגות אלקטרונים, כמו במולקולת החנקן N2, מולקולת האצטילן C2ה2.

קשרים מרובים קצרים מקשרים קוולנטיים בודדים. ה אורך הקישור מוגדר כ- מרחק בין הגרעין של שני אטומים מחוברים על ידי קשר קוולנטי במולקולה.
ההבדלים בין תרכובות קוולנטיות ליוניות
תרכובות יוניות קוולנטיות מציגות הבדלים ניכרים בתכונות הפיזיקליות הכלליות שלהם, בשל העובדה שקשריהם הם בעלי אופי שונה.
בתוך ה תרכובות קוולנטיות קיימים שני סוגים של כוחות משיכה; אחד מהם הוא זה שמחזיק את האטומים של מולקולה. מדד כמותי למשיכה זו הוא אנרגיה מחייבת. כוח המשיכה האחר פועל בין המולקולות השלמות, ונקרא כוח בין מולקולרי. מכיוון שכוחות בין-מולקולריים הם בדרך כלל חלשים יותר מהכוחות המחזיקים את אטומי המולקולה יחד, מולקולות של תרכובת קוולנטית נקשרות בפחות כוח.
בצרוף, תרכובות קוולנטיות הן כמעט תמיד גזים, נוזלים או מוצקים נמוכיםנ. מצד שני, הכוחות האלקטרוסטטיים המחזיקים את היונים בתרכובת יונית הם בדרך כלל חזקים מאוד, כך שתרכובות יוניות מוצקות בטמפרטורת החדר ובעלות נקודות התכה גבוהות. תרכובות יוניות רבות מסיסות במים, ופתרונותיהן המימיים מוליכים חשמל מכיוון שתרכובות אלו הן אלקטרוליטים חזקים.
רוב ה תרכובות קוולנטיות אינן מסיסות במים, ואם הם מתמוססים, הפתרונות המימיים שלה כרגיל הם לא מוליכים חשמל מכיוון שתרכובות אלו אינן אלקטרוליטים. תרכובות יוניות מותכות מוליכות חשמל מכיוון שהן מכילות קטיונים ואניונים הנעים בחופשיות; תרכובות קוולנטיות נוזליות או מותכות אינן מוליכות חשמל מכיוון שאין יונים.
דוגמאות לתרכובות קשורות קוולנטית
- אצטילן C2ה2
- מתאן CH4
- אתאן סי2ה6
- פרופאן סי3ה8
- בוטאן סי4ה10
- בנזן סי6ה6
- טולואן ג7ה8
- מתיל אלכוהול CH3הו
- אלכוהול אתילי ג2ה5הו
- פרופיל אלכוהול C3ה7הו
- אתיל מתיל CH3OCH3
- אתיל אתיל מתיל ג2ה5OCH3
- אתיל אתרים ג2ה5OC2ה5
- חומצה פורמית HCOOH
- חומצה אצטית CH3COOH
- חומצה פרופיונית ג2ה5COOH
- חומצה בוטירית ג3ה7COOH
- פחמן דו חמצני CO2
- פחמן חד חמצני CO
- חנקן מולקולרי N2
- מימן מולקולרי H2