30 アルデヒドの例
例 / / November 06, 2023
の アルデヒド は 有機化合物 末端カルボニル基 (= C = O) が結合した炭素鎖によって形成されます (炭素鎖の一端に位置します)。 分子)、さらに水素原子に結合します。
非常に一般的なアルデヒドは、メタナール (ホルムアルデヒド)、エタナール (アセトアルデヒド)、プロパナール (プロアルデヒド) です。

これらの化合物の一部は自然界に存在します。たとえば、バニリンまたはバニリンは、バニラの主な香味料を構成する天然のアルデヒドです。
- 「アルデヒドとケトン」も参照
アルデヒドの命名法
アルデヒドは、国際純粋応用化学連合 (IUPAC) によって確立された命名規則を使用して命名できます。
アルデヒドに名前を付けるには、炭素鎖がカルボニル基に結合している炭素原子の数を示す接頭辞が使用されます。 カルボニル基は常に炭素鎖の一端に位置します。つまり、カルボニル基は常に 1 位にあり、鎖内の位置を示す必要はありません。 さらに、接尾辞 -al がアルデヒド名の末尾に付けられます。 いくつかの例は次のとおりです。
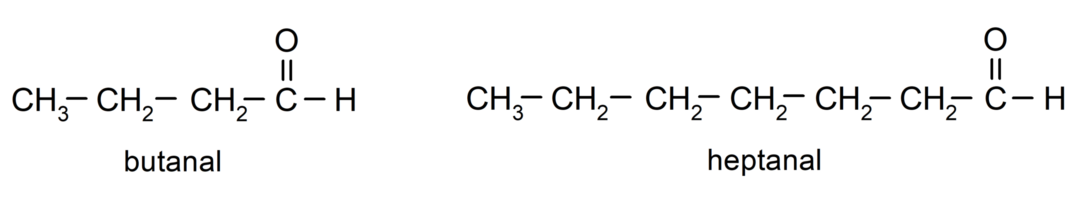
アルデヒドが分岐している場合、つまり、いくつかの炭素鎖で構成されている場合、 主鎖とは、炭素原子の数が最も多く、次の基も含む鎖のことです。 カルボニル。 残りの鎖は置換基として命名されます。
さらに、各置換基は、その位置が炭素主鎖内で可能な限り最小の番号を占めるように選択する必要があります。 一方、主鎖の炭素原子はカルボニル基を含む末端から数えられます。 いくつかの例は次のとおりです。
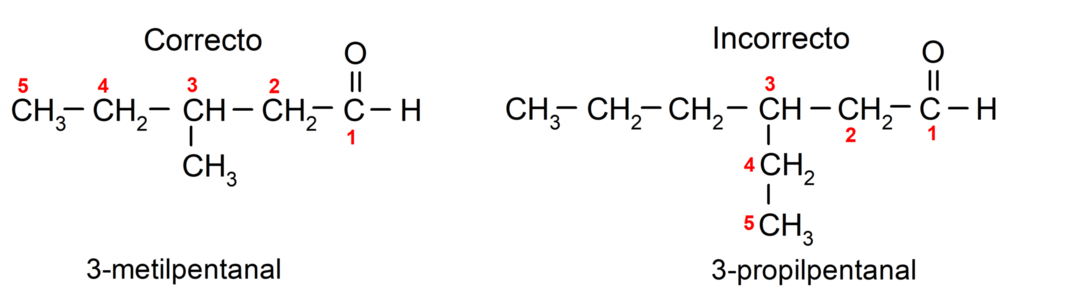
アルデヒドが分子内で置換基として機能する場合、それも基で構成されているため、 酸やエステルなどの優先度の高い官能基の場合、アルデヒド基は次のように名付けられます。 -オキソ。 例えば:

アルデヒドが複数のカルボニル基を持つ場合、それらの基の数を示す接頭辞、ダイヤル (カルボニル基 2 つ)、トライアル (カルボニル基 3 つ) などを使用して名前が付けられます。 例えば:
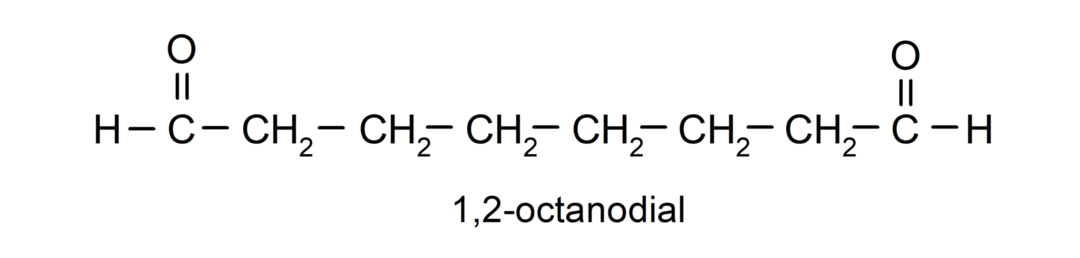
カルボニル基が環に結合している場合、アルデヒドはカルバルデヒドという用語を使用して命名されます。 例えば:

アルデヒドの物性
アルデヒドには通常、同じ物理的特性のいくつかのバリエーションがあります。 これは、アルデヒドの物理的性質がカルボニル基に結合する炭素鎖がどのように形成されるかに依存するために起こります。
アルデヒドのいくつかの物理的特性は次のとおりです。
- 溶解性. アルデヒドの水への溶解度は、アルデヒドの量に依存します。 原子 カーボンチェーンが付いているものです。 より短い炭素鎖(最大約 5 個の炭素原子)を持つアルデヒドは水に可溶です。 多くの炭素原子の炭素鎖を持つアルデヒドは水に溶けません。 メタナールとエタナールは水に非常に溶けます。
- 密度. 一般に、アルデヒドは水よりも密度が低い化合物です。
- 集約状態. 1 個または 2 個の炭素原子からなるアルデヒドは、 ガス、3 ~ 12 個の炭素原子を含むものは、 液体、12個以上の炭素原子で構成されているものは固体です。
- 匂い. アルデヒドの中には刺激臭を持つものもあれば、心地よい匂いを持つものもあります。
- 極性. カルボニル基はそれらに極性を与えます。
- 沸点. これらは同様の分子量のアルカンよりも沸点が高く、同様の分子量のカルボン酸やアルコールよりも沸点が低くなります。
アルデヒドの化学的性質
アルデヒドの化学的性質のいくつかは次のとおりです。
アルデヒドは、Tollens、Benedict、Fehling 試薬と反応すると酸化されます。 対応するカルボン酸を形成します。 形成される酸は、その炭素鎖中に、それが形成されるアルデヒドと同じ数の炭素を持ちます。 例えば:
- Tollens 試薬 (塩基性溶液中のアンモニア性銀錯体、[Ag (NH3)2]+). この反応により、対応する酸と金属銀が生成されます。

- ベネディクト試薬とフェーリング試薬による酸化(硫酸銅(II)のアルカリ溶液(CuSO)4)組成が異なります)。 この反応により、対応する酸と酸化亜銅 (Cu) が生成されます。2どちらか)。

求核付加反応を起こします, ここで求核試薬はアルデヒドのカルボニル基に付加されます。 いくつかの例は次のとおりです。
- 付加反応 アルコール アルデヒドのカルボニル基に結合してアセタールとヘミアセタールを形成します。
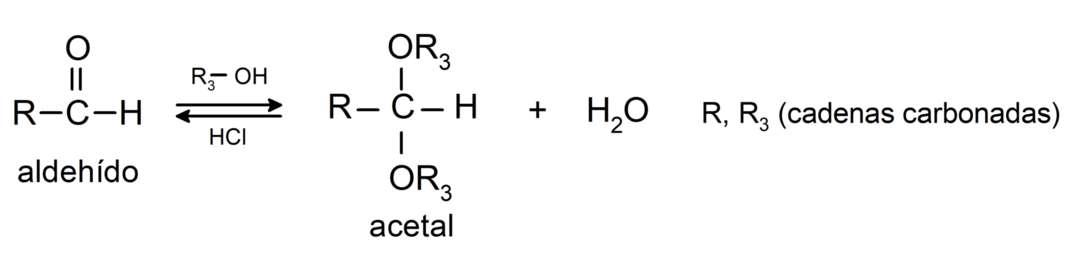
- 付加反応 アミン カルボニル基が第一級です。

- シアンヒドリンまたはシアンヒドリンが形成される青酸 (HCN) 付加反応。

アルドール縮合反応が起こります. このタイプの反応では、2 つのアルデヒドが縮合してアルドールを形成します。 これらは水酸化ナトリウム (NaOH) で起こる反応です。 例えば:
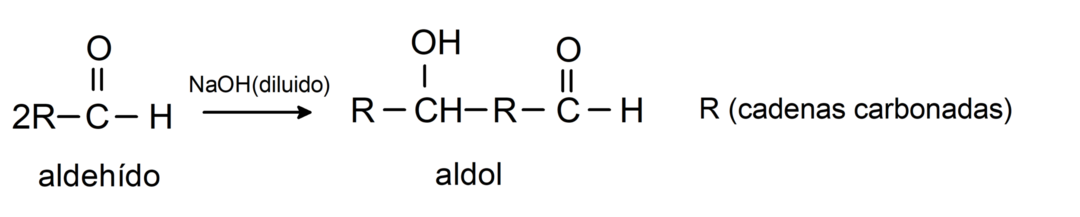
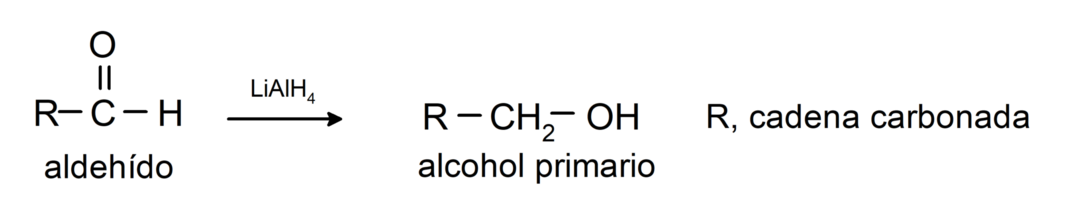
還元反応を起こして第一級アルコールになります。. 水素化ホウ素ナトリウム (NaBH4) および水素化アルミニウムリチウム (LiAlH4) の存在下、または接触水素化により、それらは第一級アルコールに還元されます。 例えば:
アルデヒドの例
- メタナール(ホルムアルデヒド)
- エタナール(アセトアルデヒド)
- プロパナール(プロアルデヒド)
- ブタナール
- ペンタナール
- バニリン
- シンナムアルデヒド
- プロペナル
- ベンズアルデヒド
- ヘキサナール
- 3-ブロモシクロペンタンカルバルデヒド
- シクロヘキサンカルバルデヒド
- 4,4-ジメチルペンタナール
- 2-ヒドロキシ-ブタナール
- 2-ヒドロキシ-2-メチル-ブタナール
- 2,3-ジメチルペンタナール
- ペンタンディアル
- シクロペンタンカルバルデヒド
- イソブタナール
- 2-クロロブタナール

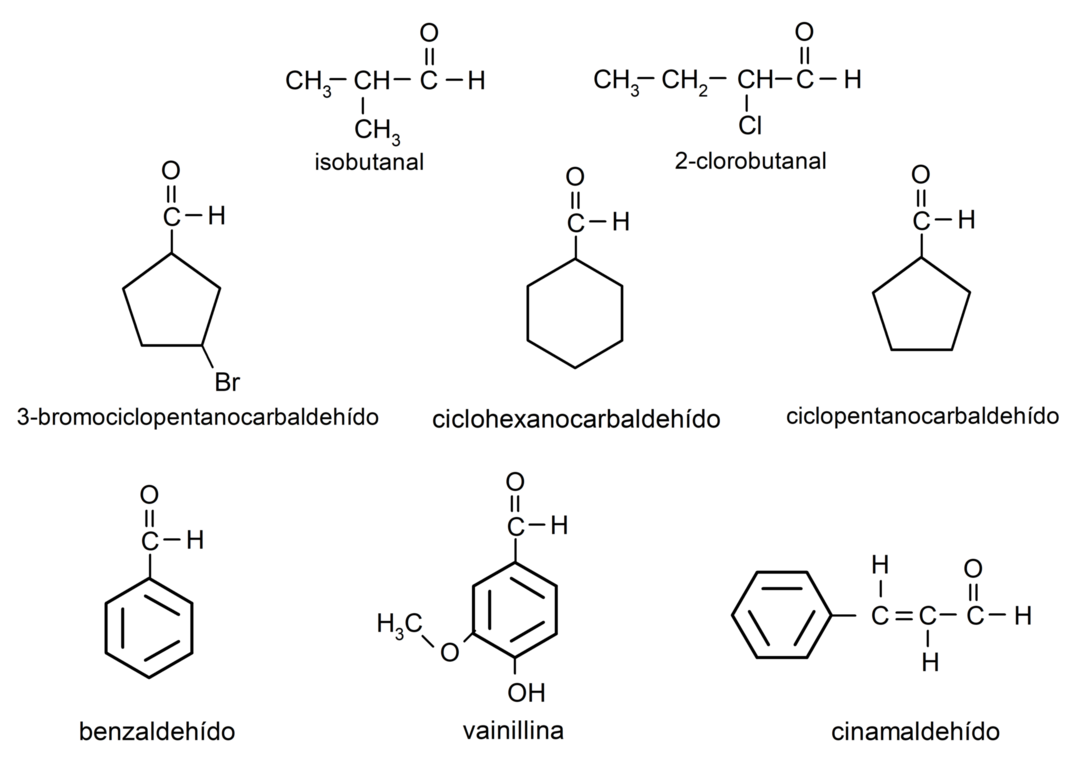
自然界のアルデヒド
自然界に存在するアルデヒドには次のようなものがあります。
- アーモンドの成分であるベンズアルデヒド。
- シンナムアルデヒドは、シナモンエッセンスの香りの元となる成分です。
- バニリンはバニラの風味を生み出す成分です。
一方、グルコースの形態の 1 つであるオープン型は、アルデヒド官能基を持っています。
アルコールの代謝中間体として生成されるアセトアルデヒドは、アルコールに酔ったときに二日酔いの症状を引き起こすと考えられています。
アルデヒドの用途
アルデヒドの主な用途には次のようなものがあります。
- これらは溶剤、塗料、化粧品、エッセンスの製造に使用されます。
- 樹脂の製造に使用されます。 ベークライトはホルムアルデヒドで作られており、電気絶縁体として非常に優れた働きをする樹脂です。
- それらは鎮静剤として使用されてきました。 パラアルデヒドは鎮静剤や催眠剤として使用されてきましたが、不快な臭いのため現在は使用されていません。
- これらは生体サンプルや死体の防腐剤として使用されます。 ホルムアルデヒドはこの意味で広く使用されています。
- これらは食品の香料として使用されます。 一例は、デザートにバニラの香りを付けるために使用されるバニリンです。
- それらは消毒剤として使用されます。
アルデヒドの危険性
いくつかのアルデヒドは発がん性があると考えられており、たとえば、ホルムアルデヒドは WHO (世界保健機関) によって発がん性化合物であると宣言されています。
多くのアルデヒドにさらされたり接触すると、皮膚、目、気道に炎症を引き起こします。 一方で、接触皮膚炎や肝臓疾患を引き起こします。
参考文献
- ソロモンズ、T.W. グラハムとマリア・クリスティーナ・サンギネス・フランキーニ(1985年)。 “有機化学メキシコ、DF:リムサ。
- ウィッテン、K. W.、ゲイリー、K. D.、デイビス、R. E.、デ・サンドバル、M. T. に。 O.、ムラダス、R. M. g. (1992). “化学全般」 (pp. 108-117). マグロウヒル。
- アルテアガ、P. M. (2017). “ケトンとアルデヒド」予備校の科学紀要第 3 号 4(8)。
以下のように続けてください:
- 砂糖
- ヒドラシッド
- エチルアルコール
- 有機化合物および無機化合物

