ペプチド結合の例
化学 / / July 04, 2021
ザ・ ペプチド結合 は 2つのアミノ酸分子が縮合によって結合している.
ペプチド結合をよりよく理解するには、最初にアミノ酸を定義する必要があります。
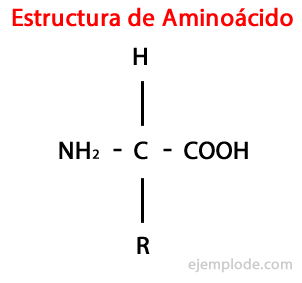
ザ・ アミノ酸は有機分子です 少なくとも含む短い アミノ基(-NH2)、本質的にアルカリ性、 およびカルボキシル基(-COOH)、性質が酸性。
生物はさまざまな目的で非常に多様な種類のアミノ酸を合成しますが、最も重要なのは タンパク質の一部であり、 これらはすべて、のクラスに属しています。 α-アミノ酸.
α-アミノ酸は、酸とアミノ基が同じ炭素原子に結合していることを特徴としています。これはα炭素と呼ばれます。 さらに、このα炭素は、第3の置換基として水素原子に結合し、第4の置換基として結合します。 置換基、さまざまなサイズと特性の追加グループで、各アミノ酸を その他。
4番目の置換基は 側鎖 アミノ酸であり、多くの場合、文字Rで簡略化された形式で表されます。
α炭素の4つの置換基が異なり、その周りに四面体配列を採用しているため、α炭素が存在します。 光学異性、これは分子が 別の形式 それは 鏡像 彼は、最終的には等しい分子ではありません。 分子のこれらの2つの異性体には、置換基が空間にどのように配置されているかに応じて、文字DまたはLが割り当てられます。 タンパク質に含まれるすべてのアミノ酸はLです。
アミノ酸は、その化学的性質に従って分類されます。 極性および無極性. Polarsは順番にに分けられます ニュートラルで帯電 (酸性または塩基性の場合があります)。 ザ・ 非極性は脂肪族または芳香族である可能性があります.
ペプチドとペプチド結合
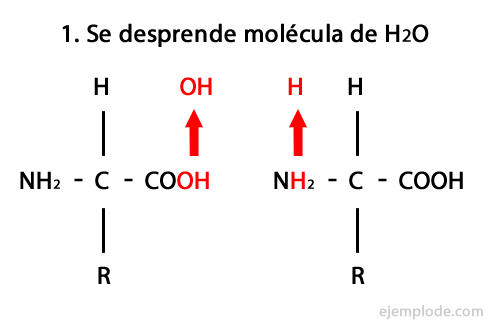
ペプチドは、アミド結合を介したアミノ酸の共有結合の産物であり、 一方のカルボキシル末端と他方のアミノ末端の縮合により、水分子が放出されます。 反応。 この結合はペプチド結合と呼ばれます。
この反応のメカニズムを以下に示します。 アミノ基とカルボキシル基、 そしてアミノ酸分子の凝縮が起こり、ペプチドを形成します。
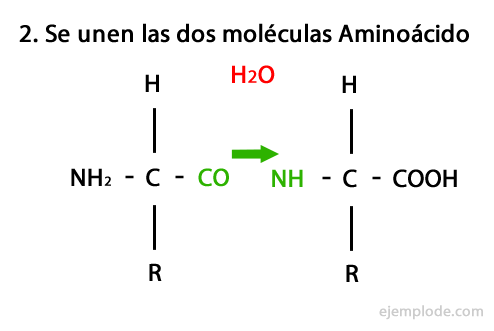

アミノ酸やタンパク質などのペプチド、 末端にアミノ基とカルボキシル基を持っている 反応せずに。
単純なペプチド、さらにはタンパク質の式を指定するには、それを構成するアミノ酸をリストするだけで十分です。 無料のアミノ基を持つものから始めます、そして無料のカルボキシル基を持つもので終わります。
体内で見つかったいくつかのペプチドは
バソプレッシン、血圧を上昇させ、腎臓での水分の再吸収を増加させます。 インクルード エンケファリン、痛みの感覚を軽減します。 そしてその オキシトシン、子宮を収縮させます。ペプチド結合の特徴
あるアミノ酸のアミノ基と別のアミノ酸のカルボキシル基との縮合、 水性溶媒中で起こります、 そのため それは自発的ではありません、したがって、タンパク質合成にはエネルギーの供給が必要です。
他のアミド結合と同様に、ペプチド結合は 2つの極端な形の間の共鳴を示します: ニュートラルフォーム、最初のアミノ酸のカルボニル炭素と2番目のアミノ酸のアミノ窒素(C-N)を結合する単結合、および 電荷を分離した形 ここでは、2つの原子が二重結合で結合されています(C = N)。 実際には、ペプチド結合は2つの極端な状況のどちらも採用しませんが、両方の共鳴ハイブリッドです。
電話があります ペプチド面、 からなる 2つの最初のアミノ酸を結合するペプチド結合に関与するすべての原子. 一方では、窒素と水素の原子で、それぞれの炭素αが最初のアミノ酸に含まれています。 一方、他のアミノ酸の炭素αと、カルボニル基の酸素と炭素。
ペプチドとタンパク質の違い
ザ・ ペプチドはアミノ酸の数が少ない、2から数十の範囲であり、溶液中のそれらのコンフォメーションは柔軟になります。
ザ・ 小タンパク質、構造的に大きなペプチドに近い、 定義されたコンフォメーションとはるかに柔軟性が低い.
ペプチドのように、無秩序で柔軟なコンフォメーションを持つタンパク質がありますが、それらが細胞内の他の高分子と相互作用するときにその順序になります。
ペプチド結合に関与するアミノ酸の20の例
- 藤
- 女の子に
- バリン
- ロイシン
- イソロイシン
- プロリン
- メチオニン
- フェニルアラニン
- チロシン
- トリプトファン
- セリン
- スレオニン
- システイン
- アスパラギン
- グルタミン
- アスパラギン酸
- グルタミン酸
- リジン
- アルギニン
- ヒスチジン
